Представяне когато разтваря във вода, те образуват алкална - защо тези метали се нарича -
Презентация на тема: "- Когато се разтваря във вода, те образуват алкална - Защо тези метали се наричат" алкални "- А каква е алкална алкални - сапунена на пипане, а сода?". - Препис:
1

2 - Когато се разтваря във вода, те образуват алкални - Защо тези метали са наречени "алкални"? - И какъв е алкална? Алкално - сапунена на пипане, а разяждащи вещества. Те са много хигроскопичен (дръпне влагата). За ефектите върху кожата, те са подобни на киселината - просто изяжда и schipyat (ако концентриран).
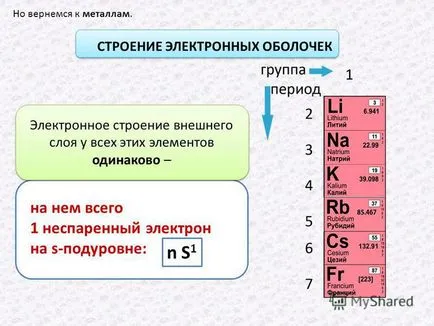
3 Но да се върнем към метали. Електрон обвивка структура върху него само един несдвоен електрон на S-подниво: п S 1 електронната структура на външния слой на всички тези елементи са еднакво -
4 В резултат на това от горе до долу в подгрупата усилени възстановителни свойства - Какво означава това? = Valence елементи 1, т.е. всеки атом могат да образуват една връзка. Степента на окисление на елементите 1 = - метални свойства - способността да дари електрони горе до долу в подгрупа атомен радиус увеличава, следователно, по-слабите един електрон се привличат към ядрото на атома - надолу метални свойства увеличават

5

6 физичните свойства на алкални метали всички електрическа и топлинна проводимост на сребро-бял цвят (CS - жълтеникаво) като мека глина плътност от Li, Na и К по-малко от 1 - те се носят на повърхността на водата като всички метали активно взаимодействат с вода (хигроскопична) - реагира с висока температура - същество изгаряне във въздуха, искра, те се съхраняват под слой на парафин

7 физичните свойства на алкален метал Всички елементи са боядисани в цвят, различен пламъци: Li в червено Na - в жълт К - в лилаво Rb - в червено-кафяво Cs - червено и лилаво

8 химичните свойства на алкални метали считат химичните свойства на неорганична класификация таблица съединения
9 с кислородни форми оксиди, пероксиди и супероксиди с различни цветове: 4Li + O 2 = 2Li 2О (бял); 2Na + O 2 = Na 2О 2 (бял); К + O 2 = КО 2 (жълто); ... Cs 2О (оранжево); RBO 2 (тъмно кафяв) .... 1. Отиваме на стрелките в синьо
10 2Na + Cl 2 2NaCl 4Na + SO 2 2Na 2О + S + 2Na 2HCl 2 NaCl + Н 2 K + NaCl KCl + Na През първите две реакции традиционно натриеви експонати редуциращи свойства. Обърнете внимание на последната реакция - реакция на металната сол е не всеки метал може да влезе в такава реакция!
11 разтворимост Таблица на дъното има ред в тази серия всяка предходна елемент може да измести ПОСЛЕДВАЩА от неговите соли
12 2. Go на зелена стрелка - реакцията на оксиди О + 2Na 2 S + SO 4Na 2О + 2Na 2 SO 2 Na 2 SO 3 Na 2О + 2HCl 2NaCl + Н 2О
13 3. Продължаваме оранжевата стрелка, за да
14 6KOH + 3Cl KClO 3 + KCl + 3H 2О гореща 2KOH + Cl 2 KClO + KCl + Н 2О студен 2KOH + SO 2 K 2 SO 3 + Н 2О КОН + HCl KCl + Н 2О Гореща Алкално - окисляване е хлор окисление до степента на 5. При използване на студен алкален хлоро окислен само един алкален реакция с киселина, наречена неутрализиране на реакцията. Две силни корозивни вещества неутрализират взаимно, за да образуват вода.
Водородът 15 чрез взаимодействие с алкални метали проявява отрицателен окислено състояние. Така получен хидриди: Реакциите на алкални метали с водород 2Na + Н2 2NaH Всички метални съединения на алкални лесно разтворими във вода. единственият начин да се определи качеството на цвета на пламъка и този цвят оксиди. Не утаяване на съединенията не образуват.
16 2LiCl 2Li + Cl 2 катод: Li + + е Li анод: 2Cl - - 2е Cl 2 4NaOH 4Na + 2Н 2О + O 2 катод: Na + + е Na анод: 4-ОН - - 4е 2Н 2О + O 2 Получаване на метали обикновено алкални метали чрез електролиза на стопилки или техни алкални соли: NaCl (електролиза) Na + Cl 2
17 Тест 1. Алкални метали алкални метали в реакции проявяват свойства: А. Б. окислител редуктор В. Как окислител и редуциращо средство G. идват само в обменни реакции 2. Най-ясно изразени свойства за намаляване на: А. Б. Li Na Б. К G. Rb
18 3. Най-лесният се подлага на окисление с въздух: А. Cs Rb Б. В. К Na 4. G. В реакцията на алкален метал с вода за получаване на оксиди B. A. основни оксиди киселина база В. G. 5. Реакционната Качествен киселина калиева сол: А. Б. замърсяване изолиране утайка обезцветяване В. G. цвят пламък разтвор
19 6. Реакция: Na + KCl A. отива да освободи К Б. отива с разделяне Cl 2 не е V. G. продължава да се образува NaCl 7. KCl + NaNO 3 Реакция А. Б. отива до края се измества към реагентите в . въпрос за образуване KNO 3 и NaCl не е Н. 8. електролизата 149 грама KCl стопена сол означава: л газ л B диоксид в газа G. L 5.6 л газ
20 9. В електролиза на солен разтвор 149грама KCl разпределени: А. 2 г от водород в водород байта л л Г. 1 г хлороводород 10. Реакционните продукти на Na2CO3 + C. A. Na 2О + СО 2 Б. Na + СО 2 Б. Na 2О + CO G. Na + CO
21 яну. B 2 D, А 3, 4, G 5, 6, 7, 8 G А 9 10 G