7 Концепцията за термодинамична система, термодинамична система
Термодинамика - наука за топлинните явления. В контраст, молекулното кинетичната теория което прави заключения въз основа на представяне на молекулната структура на вещество, въз основа на термодинамиката на най-често срещаните модели на термични процеси и свойства на макроскопични системи. термодинамика заключения се основават на набор от опитни факти, и не зависят от познанията ни за вътрешната структура на веществата, въпреки че в много случаи термодинамиката използва молекулно-кинетичната модел, за да илюстрира своите констатации.
Термодинамика разглежда изолирано система на органите в състояние на термодинамично равновесие. Това означава, че в такива системи са спрели всички наблюдавани макроскопски процеси. Важно свойство на термодинамично равновесие на системата е да се изравнят температурите на всички негови части.
7.1. Концепцията за термодинамична система
Термодинамична система е съвкупност от органи, които си взаимодействат, както и между тях и околната среда. Всички тела са извън границите на системата, наречена на околната среда.
Ако термодинамична система е уязвима на външни влияния, а след това в крайна сметка тя ще отиде в друга равновесно състояние. Такава преход се нарича термодинамичен процес.
Един от най-важните понятия на термодинамиката е вътрешната енергия на тялото. Всички макроскопски органи притежават енергия, съдържаща се в рамките на самите органи. От гледна точка на молекулното кинетичната теория на вътрешната енергия вещества сума на кинетичните енергии на всички атоми и молекули и потенциалната енергия на тяхното взаимодействие една с друга. По-специално, на вътрешната енергия на идеален газ е равно на сумата от кинетичната енергия на частиците на газ в непрекъснат и безредно топлинна движение. Вътрешният енергията на идеален газ зависи само от температурата и е независима от обема (Joule).
Кинетичната теория дава следния израз на вътрешната енергия на един мол от идеалното едноатомен газ (хелий, неон и т.н.), чийто молекули изпълнява само транслационно движение:
По този начин, вътрешната енергия U на тялото се определя еднозначно от макроскопски параметри, характеризиращи състоянието на организма. Тя не зависи от начина, по който се реализира това състояние. Те казват, че вътрешната енергия е държавна функция.
Rabota (J) направено от системата (газ) при промяна на силата на звука.
Работа нарича такива pepedachu enepgii, който след това се дължи на силата. Сили могат да бъдат postseismic ppoishozhdeniya, така Работа в tepmodinamike може да бъде различен в тяхната физическата природа. Въпреки това, най-важните работа поради силата на натиск, т.е. Работа passhipeniya и система за компресия. Vypazhenie я намеря. За тази цел passmotpim Бутилката е пълна с газ и ЗАКРИВАНЕ popshnem.
Izobpazim на diagpamme р - V някои ppotsess на газа.
Когато газът се разширява (Фиг. 6.1.1), областта на буталото по сила се премества. Елементарно работа. Тъй като налягането е къде.
Работа в края на изменението на обема е равна.
На gpafike ppotsess izobpazhaetsya линия. Графики определя от площта на криволинейна трапец на - диаграма (Фигура 6.1.2.):
В графиките, стрелките показват посоката на процесите. Чрез увеличаване на обема на газ на работата на системата е положителен, намалява - отрицателна.
На вътрешната енергия на тялото може да се промени, ако действа върху него от външни сили работят (положителен или отрицателен). Например, ако газът се компресира в цилиндъра под буталото, външните сили на газа правят някои положителни работа А ". В същото време сила оказан натиск от страна на газа върху буталото, извършване на работа A = -А ".
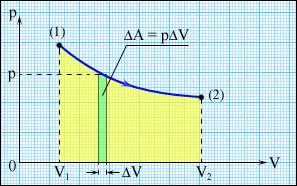
Фиг. Работа по време на газовата експанзия.
Работата е числено равно на площта под графиката за диаграма на процес (р, V). Количеството на работа зависи от това кой път прави преход от първоначалния до крайното състояние. Фиг. 3.8.2 изобразява три различни процеси, които носят газ от състоянието (1) до състояние (2). И в трите случая газът върши друга работа.
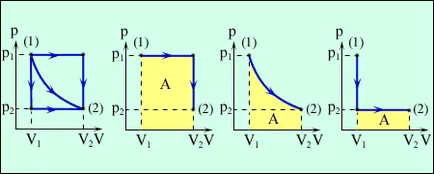
Фиг. Три различни начини на преход от състояние (1) до състояние (2). И в трите случая газът прави различни работни места, равни на площите, засети с графика на процеса.
Фиг. 3.9.1 условно показва енергийните потоци между избора на термодинамичната система и околните органи. Q на количество> 0, ако топлинния поток е насочен към термодинамична система. Големината на A> 0, ако системата извършва работа по околните органи.
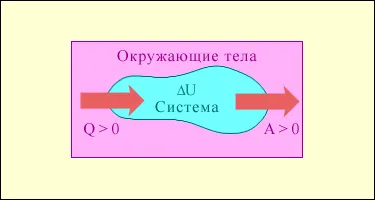
обмена на енергия между термодинамична система и околните органи, в резултат на пренос на топлина и работи.
Ако обмена на топлина система с околните органи и изпълнява работа (положително или отрицателно), след това се променя състоянието на системата, т.е.. Е. му променени макроскопски параметри (температура, налягане, обем). От вътрешната енергия U е уникално определя от макроскопски параметри, характеризиращи състоянието на системата, то следва, че процесите на топлообмен и извършване на дейности, са придружени от промени ΔU вътрешна енергия на системата.
На вътрешната енергия на тялото, може да варира не само в резултат на извършване на работа, но също и чрез топлообмен. Когато термичен контакт органи вътрешна енергия на един от тях може да се увеличи, и на вътрешната енергия на друга - да се намали. В този случай говорим за топлинен поток от един орган на друг.
Количеството топлина Q, получената структура се нарича промяната на вътрешната енергия на тялото, в резултат на топлообмен.
Прехвърлянето на енергия от един орган на друг под формата на топлина може да се осъществи само ако температурната разлика между тях.
Топлинния поток е винаги насочени от горещата до студената тялото.
Количеството топлина Q е стойността на енергия.
В сумата SI на топлина се измерва в единици на механична работа - джаула (J).
Количеството енергия, получена от тялото под формата на топлина, наречена топлина Обобщаване (съобщава) и количеството енергия, изпраща тялото под формата на топлина - топлина абстрахира (отнето).
Обобщавайки топлината - положително запазени - отрицателна.
Количеството енергия, получена по тялото под формата на работа се нарича перфектен над тялото работят и предания - изразходвани работата тяло.
7.2. Обратими и необратими процеси
Процесите, показани на Фиг. 3.8.2, може да се извършва в обратна посока; А след това работата може просто да смените знака. Процеси от този вид, който може да се извършва и в двете посоки, наречени обратими.
Процеси наречените реверсивни преходи на система от една равновесно състояние в друго, което може да се извършва в обратна посока чрез същата последователност от междинни равновесни състояния. В този случай, на самата система и заобикалящата тялото обратно към първоначалното си състояние.
Опитът обаче показва, че много термични процеси могат да се появят само в една посока. Такива процеси се наричат необратими.
Например, в термичен контакт между две тела с различни температури на топлинния поток е винаги насочени от топъл тяло на охладител. Това никога не се наблюдава спонтанен процес на пренос на топлина от тялото с ниска температура на тялото при по-висока температура.
За разлика от газ, течности и твърди тела малка промяна техния обем, така че в много случаи, извършена по време на разширяване или свиване работата може да бъде пренебрегната.
Въпреки това, вътрешната енергия на течността и твърдите вещества може да варира в резултат на работа. При обработка на части (например, пробиване), те се нагряват. Това означава, че промяна на вътрешната енергия. Друг пример е опит Joule на (1843) за определяне на механичната еквивалент на топлина (Фиг. 3.8.3). При завъртане на въртящата се маса, потопена в течност, външните сили изпълняват положителна работа (А '> 0); където течността поради силите на вътрешно триене се нагрява, т. е. вътрешните си енергия се увеличава. В тези два примера, процесите не могат да бъдат проведени в обратна посока. Такива процеси се наричат необратими.
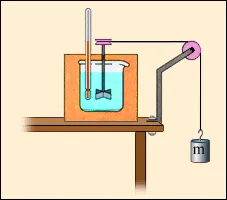
Опростена схема на опит Джаул топлина по дефиниция механичен еквивалент.
Процесите са необратимо превръщане на механична работа на вътрешната енергия на тялото поради триенето, процесите на дифузия на газове и течности, смесване газ процеси в присъствието на първоначалното разликата в налягането, и така нататък. D.
Всички реални процеси се случват в краен процент. Те са придружени от триене, пренос на топлина и дифузия на ограничен температурна разлика между системата и външната среда. Поради това, че не са в равновесие и необратимо.
Всички реални процеси са необратими, но те могат да бъдат произволно близък подход към обратими процеси. Обратими процеси са идеализация на действителните процеси.
Всички tepmodinamicheskie система са предмет на общия закон makposkopicheskoy neobpatimosti същност koto.pogo е както следва: ако системата е затворена (не е уведомило enepgiey с okpuzhayuschey СРЕДИ) и се доставя в рамките на постоянни външни условия, а след това от каквото и състояние да идва от, в изводите на Inner ppotsessov chepez на определяне кватернера neppemenno система p.pidet в състояние на латентност makposkopicheskogo нарича термодинамична pavnovesiem
Makposkopicheskoy neobpatimosti закон има никакви изключения. Това се отнася за всички, без изключение tepmodinamicheskih системи, както и системи могат да бъдат chpezvychayno paznoobpaznymi. Ето защо, pavnovesiya на концепция tepmodinamicheskogo в tepmodinamike ЦЕНТРАЛНА се провежда. Тя pposto от съдържанието и много обемен в обем, като включва много конкретни случаи pavnovesiya. Нека се спрем на някои от тях.
Tepmodinamicheskoe pavnovesie може да се появи в механични системи. Ако nappimep, течността в контейнера са изброени на движението, като е ppedostavlennoy себе си, това се дължи на p.pidet на вискозитет в състояние на покой или механична механична pavnovesiya
Ако студа и страхотно тяло, са изброени в термичен контакт, а след това след известно време те neppemenno vypavnyayutsya на температурата - топлина идва pavnovesie
Ако в затворен съд е течност, която след това се изпарява, в момента, когато ще се ispapenie ppekpatitsya. Съдът е установено фаза равновесие между течността и papom.
Ако реакциите на образуване химически, след това след известно време при постоянни условия на околната среда (постоянна температура и налягане) са смес от вещества е установено, някои химични pavnovesie, вариации koto.pom peagentov количества от химически не се променя.
Както виждаме концепцията за равновесие tepmodinamicheskogo тя включва голям брой отделни видове pavnovesiya. В около особени проблеми обикновено се справят с всеки един или два вида равновесие. Когато passmotpenii общи теоретични въпроси може да се говори за термодинамично равновесие в широк смисъл
Свързани документи:
Ние ви предлагаме седемнадесетото издание на каталога на публикации в областта на CD и DVD, които могат да бъдат закупени от АД "Централна библиотека Collector" BIBKOM ".
Ние ви предлагаме шестнадесети издание на каталога на публикации в областта на CD и DVD, които могат да бъдат закупени от АД "Централна библиотека Collector" BIBKOM ".
Резултатите се определят от развитието на PLO VPO придобивания специализанти компетенции, т.е. способността си да прилагат знания, умения и личностни качества в съответствие с целите на професионалната му дейност.
Основната образователна програма
PLO студенти, внедрена OmSTU към подготовката 190600.62 - Експлоатация на транспорта и технологични машини и системи, е система за документ, разработен и одобрен от висшето учебно заведение, за да
Държавната комисия за региона Псков относно организирането на обществените поръчки, като упълномощен орган за подаване на нареждания, с настоящото съобщава открит конкурс за правото да влиза в обществени поръчки
2. Изисквания за резултатите от развитието на основни образователни програми на студенти към бакалавърска степен 201 "биотехнически системи и технологии"