правило октет
препис
Един октет правило. Защо се образува някаква връзка? Ковалентното химична връзка, видове и механизми на образуване. Подробности за връзката ковалентна (енергийна връзка и полярност). Йонна връзка. Металик връзка. Водородна връзка Електроотрицателност. Степен на окисление и валентността на химичните елементи Решаване на типични задачи A4, A5
2 вида ковалентна химическо свързване метален йон водород полярен неполярен взаимодействие е химически атома облигации, извършени чрез обмен на електрони. Причината за образуването на химически връзки в получат енергия атомна система в сравнение с изолираните атоми.
3 + потенциал енергия -prityazhenie отблъскване свързване енергийна зависимост от потенциалната енергия на двата атома на internuclear дистанционна комуникация връзка Дължина Дължина равновесие internuclear разстояние, което съответства на минималното потенциалната енергия. На силата на свързване се съди от своята енергия. Обикновено, свързващата енергия на разбиране или освободен в образуване на връзка на енергия атома, или минималната енергия, необходима да се прекъсне връзката на homolytic тип. internuclear разстояние
ако ($ това-> show_pages_images $ PAGE_NUM док [ 'images_node_id'])
4 Защо се формира някаква връзка? Когато химичното свързване атоми са склонни да придобие стабилна vosmielektronnuyu (или две електрон) външна обвивка, съответстващ на структурата близкия за инертен газ атом. Движещата сила за причиняване на атомите са свързани помежду си, е тенденцията да приеме или изпращане електрони комбинират, за да се получи изцяло запълнена външен електронен корпус (правило октет) а.
5 йонийски образуване на връзка В йонно свързване метален атом губи електрони и става не-метален атом. Na 1s 2 2s 2 2p 6 3s 1 - един електрон външно Cl 1s 2 2s 2 2p 6 3s 2 3P 5 - седем електрони външно Ако натриев атом предават само си Zs-електронна атом правило хлор октет е налице както за атома: Na + Cl - 1s 2s 2 2 2p 6 - осем електрони външно 1s 2s 2 2 2 2p 6 3s 3P 6 - осем електрони външно
6 йонна връзка заредени атоми образуват от загубата или придобиване на едно или повече електрони се наричат йони. Положително заредени йони се наричат катиони и отрицателно заредени аниони се наричат. Привличането на противоположно заредени йони се нарича йонна връзка. Той възниква в съединенията образувани от метал и една или повече неметали: MgCl2, Fel 2, CUF, Na 2 О, Na 2 SO 4. Прехвърлянето на електрони от метал атом, към атом и неметални образуване йон е възможно благодарение на факта, че неметали имат висока Електроотрицателност и ниска метали. Поради силното привличане на йони помежду си йонни съединения са предимно твърди и имат относително висока точка на топене.
7 ковалентна връзка ковалентна връзка (от латинската дума "с" заедно и «Vales» като сила) се извършва чрез електронна двойка, принадлежащи към двата атома. 1 H 1s - един електрон Cl 1s 2s 2 2 2 2p 6 3s 3P 5 - седем електрони във външната ниво, всеки от двата атома липсва един електрон да има пълен външната електрон черупка. И всеки атом пресата като цяло използват един електрон.
8 има обмен ковалентна връзка и механизъм донор-акцептор на образуване на ковалентна връзка. 1) Механизмът за обмен. Всеки атом дава един несдвоен електрон в общата електронна двойка 2) Донор-акцептор механизъм. Един атом (донор) осигурява двойка електрони, а другата атом (акцептор) предвижда за тази двойка свободен орбитален;
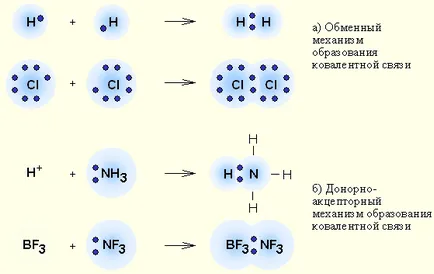
9 Механизми на ковалентна връзка
10 неполярен полярен ковалентна връзка, ако плътността на електрони е разположен симетрично между атомите, ковалентна връзка се нарича неполярен Ако плътността на електрони е изместен към един от атомите, тя се нарича полярен ковалентна връзка. Полярността на връзката е по-голяма, толкова по-голяма разлика в Електроотрицателност Електроотрицателност атоми - е способността на един атом да привличат електрони от друг плътност атома. Най-електроотрицателни елементи - флуор, най-електроположително - Франция.
11 Многообразието комуникация Освен единични връзки могат да образуват двойна или тройна ковалентна връзка, като в молекулите на кислород О 2 и азот N 2. Азотните атоми са пет валентните електрони, следователно, необходимо за завършване на черупката има три електрон. Това се постига чрез социализация три двойки електрони, както е илюстрирано по-долу: ковалентни съединения обикновено газове, течности или твърди вещества относително ниски
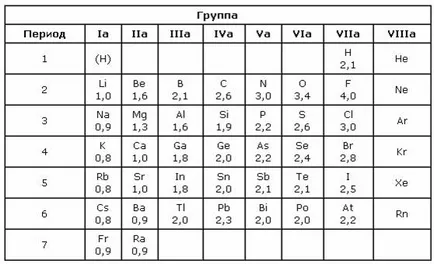
14 Електроотрицателност разлика елементи в съединението (δX) позволяват да се прецени вида на химична връзка. Ако стойността на δ X = 0 връзка ковалентна неполярен. Когато разликата в Електроотрицателност до 2.0 полярен ковалентна връзка се нарича, например: H F връзка в молекулата флуороводород HF: δ X = (4,0 2,1) = 1,9 Връзките с разликата в Електроотрицателност над 2.0 се считат йонен. Например: Na Cl връзка в съединението с NaCl: δ X = (3,0 0,9) = 2,1.
Метални Метали облигации 15 притежават специфични свойства, различни от свойствата на други вещества. Такива свойства са относително високи точки на топене, способността да отразява светлината, висока топлинна и електрическа проводимост. Тези функции са необходими за съществуването на специален вид комуникация метали метална връзка. Метални връзка възниква в резултат на делокализация на валентните електрони, които са достатъчно свободно да се движат в металната решетка, взаимодейства с положително заредени йони.
16 водородна връзка Полинг Scale водороден атом, флуорен атом, свързан с кислород или азотни атоми могат да образуват друга допълнителна връзка. Тъй като по принцип молекула силно електронна двойка се компенсира от водороден атом, към електроотрицателна елемент, той протон реагира с неразделен електронна двойка на друг атом, си общуване. Тази химична връзка нарича водородна връзка. Водородното свързване е взаимодействието между две електроотрицателни атоми от един или различни молекули от водороден атом: Н В (по-долу означава ковалентна връзка, водородна връзка три точки).
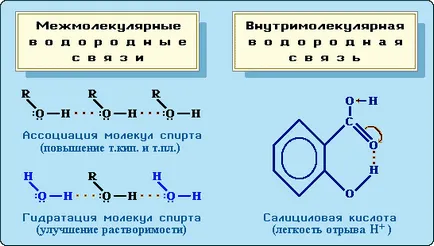
18 Влияние на водородни връзки за свойствата на веществата водородни връзки засяга физически (т.к. .. нестабилността на топене и вискозитета) и химически (киселина-база) свойства на съединенията. междумолекулни водородни връзки са отговорни за асоцииране на молекули, което води до по-високи точки на кипене и агенти на топене. Например, етилов алкохол, C 2 H 5 OH, способни за свързване, кипи при 78.3 ° С, и диметилов етер СН3 ОСН3 които не са водородни връзки само при -24 ° С (молекулна формула на двете вещества, С2-Н 6 О ). Образуването на H-връзки с молекулите на разтворителя подобрява разтворимостта. По този начин, метилови и етилови алкохоли (СН3ОН, C 2 H 5 OH), образуващи H-връзки с водните молекули се разтварят в него за неопределено време. Вътрешномолекулни водородни връзка специално засяга свойства. Например, Н-връзка в молекулите на салицилова киселина повишава неговата киселинност.
19 нуклеинова киселина и протеин вторична структура елементи (например, α-спирала, β-кратно) и в третичната структура на протеинови молекули, ДНК и РНК са стабилизирани чрез водородни връзки. В тези макромолекули, водородни връзки блокировка част от същата макромолекула, карайки го да се прибират в определена форма.
25 окисляване атома йони преход на електрони електронни ключове не са напълно но частично. Си представим, че електрона е напълно приет от водороден атом с атом на хлор: йонна връзка електростатично привличане такива такси условно повикване окисление.
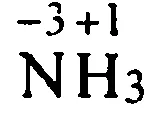
Степента на окисление на 26 - това кондиционирани заряд на атома в молекулата, изчислено на предположението, че молекулата се състои от йони и електрически неутрален като цяло. Правилата за определяне на степента на окисление: 1. CO всеки елемент по прост вещество (H 2, Al, S) е равна на сумата от всички CO атома в молекулата е най-електроотрицателните елементи са отрицателни в съединение CO на и атоми на елементи с по-ниска Електроотрицателност - положително. CO 4.Maksimalnaya произволен брой елемент група равна на (изключение: мед, сребро, злато, флуор, кислород), и минималната е равна на отрицателен 8 N, където N брой група.
27 Постоянно CO: алкални метали 1 Mg, Be и алкалоземен метал 2, 3 алуминиев флуорид водород -1 1 (с изключение хидриди NaH, СаН 2 и т.н., където степента на окисление на водород -1.), Кислород -2 (с изключение на F 2-1 О 2 и пероксиди, съдържащи група OO, при окисляване степента на кислород -1)
28 степени на окисление на някои елементи
Пример 29 се изчисли степента на окисление
30 валентност способност атоми да образуват определен брой връзки с други атоми. Valence възможности атома се определят: броят на несдвоени електрони (един електрон орбитали); присъствие на свободни орбитали; присъствие на несподелени електронни двойки.
Валенцията 32 не слага и не може да бъде нула, а степента на окисление се изисква и се характеризира марка може да има стойност, равна на нула.
33 Определяне на валентност и окисление състоянието на азотни атома в амониев йон NH 4 + Решение: амониев йон NH 4+ азотен атом образува четири единични връзки до водородни атоми, така че азотът е валентна IV. Ние се определи степента на окисление на азотен атом: х + 4 = + 1; х = + 3; А: е валентността на азот IV, и степента на окисление -3.
34 Определяне на валентност и окисление състоянието на фосфорни атоми в Н фосфорната киселина 3РО 4 (1) 3 + х + (-2) х 4 = 8 = 0 х = 5 х = 5 0
35 Определяне на окисление и валентността на азотния атом в азотна киселина + 1-2 HNO х + (-2) = 0 3 х = 0 х = 5
36 По-висока стойност на валентност равен на броя на атомните орбитали, които атом могат да бъдат използвани за образуване на ковалентни връзки. Азот chetyrohvalenten в азотна киселина, степента на окисление 5
37 образуването на връзки между атоми в молекулата азотна киселина
39 Кратко структура на уроците по курса на седмица (16 уебинари) 2. Затворен форум за изучаване 3. Редовен ефективност мониторинг. 4. Постоянни записи за достъп от всички семинарите, да резюмета и други. Материали.
41 Благодаря ви за вниманието! Ще се видим в следващия урок!