Лекция 2 ctroenie атом
Структура атома. Модерната форма на Периодичната закона.
Quantum-механично описание на електрон на атом
3 Получаване на електрони обвивка на атома.
4-измерение основни закони електрони запълване нива, поднива и орбитали в електрони обвивка на атома
5 E конфигурация атоми и Периодичната система.
Структура атома. Модерната форма на Периодичната закона.
Откриването на периодичния закон е предпоставка за създаването на ХХ век. теорията на атомната структура.
През 1911, Ernest Rutherford, предложен ядрената модел на атома.
Според този модел атом състои от положително заредени ядро и ядро орбита отрицателно заредени електрони. Носителят на положителния заряд на ядрото е протон.
Съставът включва също атомни ядра неутрони - елементарни частици. които нямат електрически заряд.
Броят на електроните е равен на заряда на ядрото. Един атом като цяло е електрически неутрален. Най-простият ядрото е ядро на водородния атом. заряда е 1, относителното тегло - около 1 а. д. т. Ядрото на водородния атом е наречено протон *. заряд на протона е равно по сила и противоположни по знак на заряда на електрона.
Размерите са приблизително 10-8sm атом. размер на ядрото - около 10-13 10-12cm. Въпреки факта, че размерът на ядрото в десетките хиляди пъти по-малки от целия атом, преобладаващата част от масата на атома е съсредоточена в ядрото.
През 1913 г. английският физик Х. Моузли установено, че ядрената таксата е числено равно на поредния номер на елемента в периодичната система.
По този начин, заряд на ядра атом стане основна характеристика на химичния елемент.
От това следва, модерната форма на партида Кона -
Свойствата на елементите и свойствата те образуват прости и сложни вещества периодично в зависимост от заряда на ядрата на атомите.
Moseley изследвания са потвърдили точността на местоположението на периодичната система на елементите, които въз основа на стойностите на техните атомни маси, са "от позиция": на аргон (Аг = 39.9) преди калий (Аг = 39.1), кобалт (Co = 58.9) към никел (Ni = 58,7) и телур (Te = 127,6) към йод (I = 126,9). В съответствие с големината на ядрото на такса-E, тези елементи са били поставени в правилната система на Менделеев.
Quantum-механично описание на електрон на атом
През 1900 G. М. Планк да обясни поведението на електрона в атом квантовата предлага хипотезата, че енергията на електроните в един атом може да излъчват или да абсорбира само някои части - кванти.
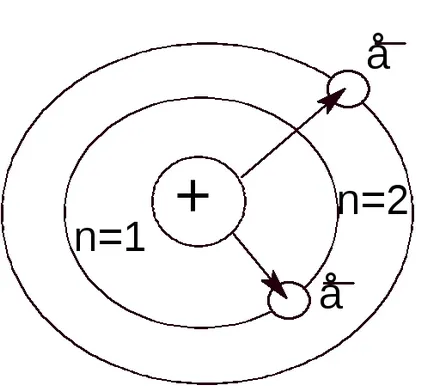
През 1913 г. Niels Бор използва квантовата теория да обясни, на спектъра на атомен водород на предположението, че електроните в атома могат да бъдат само в някои "разрешава" орбити, които отговарят на определени енергийни стойности. Бор предполагат, че са в тези орбити електронът не може да излъчва енергия до тогава. докато тя няма да направи прехода от една орбита на друга.
теория Бор има точно изчисляване на честотата спектрите на водороден атом, а другият-електронни системи, т.е.. Е. йони, като например хелий, литий, берилий.
Въпреки това, на прехода към по-сложни електронни системи - много електрони - теория на Бор е недостатъчно.
Имаше нужда от една по-обща теория, наречена квантовата механика. Такава теория описва поведението на електрона в атом.
В годините 1923-1927 са формулирани основните принципи на квантовата механика.
квантово-механична теория има две основни разпоредби.
Електрон има двойствена природа. Той има свойствата на двете частиците и вълните едновременно.
Electron като частица има маса и заряд. Въпреки това, движението на електроните - е процес от вълна. Електроните се характерни дифракционни явления настроени (това означава, че електроните могат да се движат около препятствия).
позиция от електрон на атом е несигурна.
Това се превежда-chaet, е невъзможно да се едновременно и точно определяне на скоростта на електрона, и неговите координати в пространството.
Електронни, което се движи при много висока скорост, може да бъде във всяка част на пространството около ядрото, и моментната позиция различна форма на т.нар облак sneravnomernoy moeelektronnoe плътност отрицателно отрицателен заряд (фигура 3.1).
Формата и размера на електронен облак може да бъде различен в зависимост от електронна енергия.
За химическите характеристики на елемента, което се определя от състоянието на електрони в електрони обвивка на атома е необходимо да се знае:
- енергия на електрона в атома (по-точно, енергията на система, ко-подреждане на този електрон, други електрони и ядрото;
- формата на данните от електронен облак генерирани електрон.

Електрона държави в атом, могат да бъдат описани с помощта на четири квантово число: основни, орбитален и магнитна въртене.
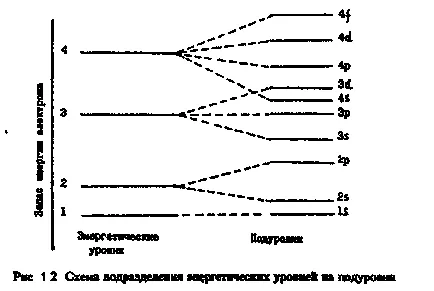
В зависимост от енергията на електроните в атома разпределени енергийни resou кал нива и поднива.
Основният квантовата броя (п) представлява енергийното ниво и определя размера на електронен облак, т. Е. средното разстояние на електрона от ядрото.
Основният квантовата брой е цяло число 1, 2, 3. п, които съответстват на броя на енергийно Урс нежелани събития.
По-голямата п е, толкова по-електронна енергия, поради минималната енергия съответства на първото ниво (п = 1). По-високи стойности на п отговарят на по-високи стойности на електронна енергия. Колкото по-голяма енергия на електрона, толкова повече отстранен той е от ядрото.
По-голяма стойност на основната квантовата брой съответства на по-голям размер на електронен облак. Електрони, които се характеризират с една и съща стойност на основната квантово число п, електронни облаци, образувани приблизително със същия размер.
Или страна орбитално квантово число (л) символи-zuet енергия подниво определя формата на електронен облак
Orbitalnoeilipobochnoe брой квантовата (L) е цяло число от 0 до (п - 1). Неговата стойност обикновено се нарича цифри и букви:
Броят на възможните стойности на L съответства на броя на възможните поднива на това ниво, равно на броя на нивото (п).
В 5,6,7 енергийни нива, както и 4 може да бъде разположена на електрона 32 (5S, 5р, 5d, 5е)
Основни закони на измерението пълнене електрони нива, поднива и орбитали в електрони обвивка на атома
Пълнене електрони ниво, поднива и орбитали в електрони обвивка на атом-определя по следната право измерение:
I- Принципът на минимална енергия: равновесните електрони тронове са на най-ниските нива на енергия и поднива.
Това означава, че всеки нов електронен влиза атома до най-ниската (в енергия) подниво безплатно. За поставените-goelektronnogo енергийни орбитите атоми в нивата и промени поднива-nyah както следва: 1s <2 s <2р <З s <Зр <4 s <3d <4р <5 s <4d <5р <6s <4f ≈ 5d <6p <7s <5f ≈6d <7p .
Пълнене последователност от атомарни орбитали, в зависимост от стойностите на основните и орбитални квантово число определя правилата Klechkovskii:
чрез увеличаване на заряд на атомно ядро последователно пълнене на атомна орбитала с електрони от орбитали случва с по-малка величина количество от основната и орбитални квантово число (п + L), за да орбитали с голяма стойност на тази сума;
2) при еднакви стойности на сумата (п + L) орбитали пълнене среща в посока на нарастване на стойностите на главно квантово число (Таблица 1.2).
Таблица 1.2 - Последователността на пълнене на атомната
По този начин, въпреки че 3D-орбиталния елементи вече се появяват в третия период, 3D-орбитали пълнене се извършва само след напълване на 4S-орбитали, т.е. елементи в четвъртия период.
принцип Ш Pauli изключване: атом не може да бъде два електрона със същите стойности на четири квантови числа.
Всеки орбитална - енергийно състояние, което се характеризира със стойности на трите квантови числа; N, liml. Тези числа определят размера, формата и ориентацията на орбитален пространство. Следователно, в един орбитален може да бъде не повече от два електрона, и те ще варират в стойността на Th-завъртания (спин) квантовата номер: TS = +1/2 или - 1/2
правило IV- Hund е: максималния брой електрони попълнете свободни орбитали, така че броят на електроните несвоен е най-голяма по време на формирането на електронните поднива.
Atom стабилно състояние съответства на разпределението на електроните в подслой, където абсолютната стойност на максималното общо въртене (правило Hund е). Следователно, когато завършване р-орбитали от въглеродни атоми и азот изпълва всеки електрон орбитален на свободните, не се свърже с друг електрон.
Структурата на електрони обвивка на атома и елементи за местоположение-среда в периодичната система са свързани помежду си. Знаейки разлагане по-елемент в периодичната таблица, е възможно да се определи структурата на електрони обвивка на един атом на всеки елемент.
номер на последователност на елемента в периодичната таблица на заряда доказва ядрото на атома и броя на електроните в атома.
период номер, съответстващ на броя на енергийните нива в електрони обвивка на атоми на всички елементи на даден период от време.
номер на група съответства обикновено на броя на валентните електрони в атомите на елементи в групата.
Валентен електрон - електрони е най-новото енергийно матик нива. Валентен електрон имат максимална енергия, и са включени в образуването на химични връзки между атоми в молекули.
Атомите на елементи основна група (А) от всички валентните електрони са в последно ниво на енергия, и техният брой е равен на броя на група.
Страничните елементи на подгрупи атома (В) в крайния енергийно ниво nahoditsyane два електрона, OC-тал валентните електрони са нива napredposlednemener енергия. Общият брой на валентните електрони, като правило, равен на броя на група.
Броят на запълнени нива електронна енергия в брой атом съответства на периода, в който елементът-мент: атомите на елементите I период - ниво на енергия, по-атома период II - две и т.н.
Най-голям брой електрони при енергийно ниво, равно на:
където п - брой на нивото или основното квантово число.
Ето защо, на първо ниво на енергия може да бъде не по-тучни ditsya повече от два електрона, а вторият - не повече от 8, третата -не повече от 18, на четвърти - не повече от 32.
А сега да разгледаме структурата на едно ниво електрон. Като се започне от = 2 енергийни нива стойността п се представи-разделяне на подслоя, които се различават един от друг поради енергията на ядрото. Броят на поднива е равен на броя на главния Куан-tovogo, но не надвишава четири.
Н
Разпределението на електрони от нива и поднива (елек-тронни конфигурация на атома) се записва като формули електрон-ционни.
Например, д формула на натриев атом се изписва като:
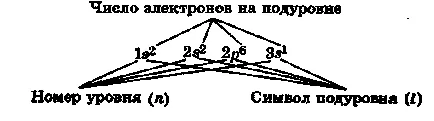
Електронната конфигурацията на атомите и периодичната система.
Електронни конфигурация атом - разпределението на всички електрони на атома в нива, поднива и орбити.
Има 2 начина да се опише конфигурацията на електрони:
1 - електронно формула
2- електрон-графики конфигурация.
За типичен атомната основно състояние (минимум енергия) или състояние на покой и възбудено състояние.
Елементи на първия период (H, He)
номер на последователност в периодичната таблица елемент ravenzaryadu ядро атом Z, и следователно iobschemu брой на електроните в атома.
Най-стабилен (спокоен глас) електрона в състояние атом съответства на минималната възможна стойност на енергия на електрона.
Всяка друга държава е развълнувана; от нея спонтанно отива в електронен състоянието на по-ниска енергия.
В спокоен глас водороден атом, (Z = 1) само електрона е възможно най-ниското ниво на енергия: п = 1. В този случай, квантовата номер орбитален може да отнеме само една стойност L = 0. По този начин, първо енергийно ниво се формира само S-орбитален, и когато електронът.
Електрон алгоритъм водороден атом:
Електронни формула водороден атом: 1s 1.
хелий атом (Z = 2), вторият електрона също се намира на 1s орбитала. Електронни формула на хелий атом: 1s 2.
Електрон алгоритъм хелий атом:
Елементи на втория период (Li - Ne)
В следната хелий елемент - литий (Z = 3) - трети електрон не може да остане в първото ниво на енергия, като в един орбитален не може да бъде повече от два електрони. Следователно, третата електрона трябва да бъде разположена на втория енергия ниво п = 2.
Когато п = 2 квантовата номер орбитален може да две стойности: L = 0; 1. По този начин се образува второ ниво енергия орбитали на два вида: една S-орбитални и три р-орбитали.