Химическа от
катализатор е от голямо значение в индустриалната реализация на каталитични процеси.
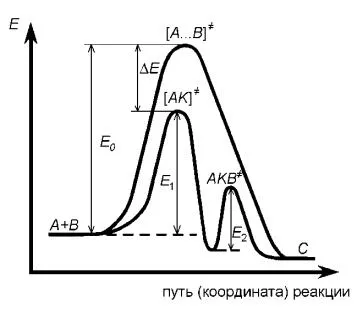
5. При положителен катализа на катализатора намалява активиращата енергия на реакцията. Това се дължи на факта, че енергията активиране за образуването на междинни комплекси на катализатора с изходните реагенти и образуването на тези реакционни продукти обикновено е много по-ниска от енергията на активиране на некаталитична реакция.
Фигурата (8.1) е представен от промяната на системата енергия в каталитичната и некаталитичен бимолекулярен реакцията
Фигура - 8.1 Промяна в потенциална енергия в хомогенна каталитични и не-каталитични реакции
В отсъствието на катализатор, механизмът може да бъде представен от
Намаляването на активиране енергия Е А съответства на (обикновено
От последното уравнение след няколко важни извода:
1. скоростта на реакцията е пропорционална на първоначалната концентрация на катализатора С 0 К.
2. Като цяло, от порядъка на реакцията ще бъде фракционна.
3. Ако К А К pavn. »1, тогава υ = к 3 K 0 ° С и реакционната смес става нула реакция цел на изходния материал А. Това означава, че всички комплекс катализатор е свързан с междинния продукт и скоростта на реакцията се определя от редица.
4. Ако К А К pavn. «1, след това υ = к 3 к р C A C 0 ° С и реакцията е реакция от първи порядък на изходния материал; пА = 1.
По този начин, от порядъка на реакцията варира в зависимост от концентрацията на реагентите (изходен материал А). Тази функция само притежават каталитична реакция.
8.4 хетерогенен катализ
Хетерогенна катализа е от решаващо значение в съвременните химическата промишленост според някои оценки до 70% химически продукти, произведени с помощта на geterogennokataliticheskih процеси. Като примери синтез на сярна киселина на основата на каталитично окисление на серен оксид (IV) SO 2 до серен оксид (VI) SO 3 на платина ванадий катализатори (Pt, V 2О 5); синтез на амоняк от водород и азот в железни катализатори насърчавани с оксиди на калий, алуминий; окисляване на амоняк, за да азотни оксиди до платинови катализатори (азотна киселина) и други.
Защото в хетерогенна катализа, катализаторът представлява отделна фаза и каталитични процеси, протичащи в нейната повърхност (фаза интерфейс), след това голяма роля в хода на
хетерогенни каталитични реакции се играе от процеси на пренос на маса. Те се характеризират с всички функции, които бяха разгледани в изследването на хетерогенни химични реакции, т.е. процес може да бъде ограничено от един етап и се провежда в разпространението, или кинетична преход региона. Понастоящем се смята, твърдо установено, че каталитичното действие чрез химическо взаимодействие настъпва етап реагенти с повърхността на катализатор или с отделните му части, наречени активни сайтове. Ролята на активните центрове често играе издатини и ребра на кристалната фаза на повърхността на катализатора, кристални дефекти и т.н.
Като цяло, хетерогенни каталитични процеси могат да бъдат разделени в следните стъпки:
1. дифузията на прекурсори от разтвор или фазата на газ към повърхността на катализатор,
2. Адсорбция на молекули на изходните материали върху катализатора активни центрове, поради химически и електро-статичен сили с някаква форма на междинно съединение:
3. Активиране на състоянието на адсорбирания (необходима за тази енергия е вярно енергията на активиране):
4. разпадане активен комплекс да се образува
адсорбирани реакционни продукти:
5. десорбцията на реакционните продукти от повърхността на катализатора.
6. разпространение на продукти от реакцията на катализатор повърхност. Тъй като хетерогенно каталитично реакцията да настъпи между най
адсорбира върху активните места на молекулите, уравнението на скорост на такива реакции са повърхностно концентрации на реагентите. Например, хидрогенирането на етилен в катализатор мед настъпва между адсорбираните етилен и водородни молекули:
C 2 H 4 (реклами.) + Н2 (реклами.) = C 2 H 6.
и скоростта на реакцията е пропорционална на продукта от концентрации на повърхността:
експериментален действителност като катализатор отравяне изключително малко количество отрови, които могат напълно да подтискат активността на катализатора.
Особеност heterocatalytic процеси е способността на катализатора до отравяне и промоция.
Повишаване - повишаване активността катализатор в присъствието на вещества, които не са се катализатори за този процес (промотори). Например, за никел-метал-катализирана реакция
CO + Н 2 -> CH 4 + Н 2О
прилагане на никелов катализатор церий малък примес води до рязко нарастване на катализатор активност.
Отравяне - рязко намаляване на катализатор активност в присъствието на някои вещества (така наречените каталитични отрови ..). Например, за синтез на амоняк реакция (катализатор - гъбесто желязо) присъства в реакционната смес, кислородни или серни съединения причинява драматичен спад в активността на катализатора на желязо; в същото време способността на адсорбирайки прекурсори катализатора намалява съвсем малко.
Основните съвременните теории на хетерогенен катализатор са теория мултиплет и теорията на активните състави.
Мултиплет теория. Според тази теория активното място е колекция от няколко адсорбционни места върху повърхността на катализатора. В адсорбция взаимодействие молекули образуват комплекс мултиплет при активното място, при което се преразпределя комуникация и формира реакционни продукти. Адсорбция се извършва в съответствие с принципите на геометричната и енергия съответствие.
РЕЗЮМЕ геометрична кореспонденция е, че разположението на силата в центъра на мултиплет трябва да съответства на разположението на атомите в молекулата на адсорбирания.
Съгласно принципа на мощност съвпадение, оптималната маса на катализатора отговаря на условието за равенство на енергията на образуване и унищожаване комплекс мултиплет. Твърде слаб и твърде силно взаимодействие на реагентите с катализатора е нежелателно.
За да се обясни тези функции на хетерогенни каталитични процеси G. Taylor прави следното предположение: каталитично активната не е цялата повърхност на катализатора, но само някои eѐ области - т.нар активни центрове. които могат да бъдат на различни дефекти на кристалната структура на катализатор (например, издатини или вдлъбнатини по повърхността на катализатора). В момента не съществува единна теория на хетерогенна катализа. мултиплата теория е разработен за метални катализатори. Основните разпоредби на мултиплет теория са както следва:
1. активен катализатор е колекция от определен брой адсорбционни центрове, разположени на повърхността на катализатор в съответствие с геометрична структура на трансформация молекула подложени.
2. При взаимодействие адсорбционни молекули образуват комплекс мултиплет при активното място, което води до преразпределение на връзки, водещи до образуването на реакционни продукти.
Теория мултиплети понякога се нарича теория на геометричната сходство на активното място и реагиращи молекули. За различни реакции, броят на адсорбция центрове (всеки от които се идентифицира с метален атом) в активното място е различен - 2, 3, 4 и т.н. Такива активни сайтове се наричат съответно, дублет, триплет, квартет, и т.н. (Обикновено т, и които дължи името си на теорията).
Теория на активните състави. Според тази теория, каталитичния процес протича при група от атоми, наречен активен ансамбъл. За разлика мултиплет теория, активни ансамбъл атоми не са елементи на кристалната решетка и катализаторът могат да мигрират свободно в рамките на определена област от повърхността на катализатор. Миграцията се ограничава от потенциалните бариери, които възникват поради микроскопични пукнатини, наличие на примеси, нееднородност на твърдата повърхност.
8.5 Ензимно катализ
Изключителна стойност в хомогенна катализа се ензимна катализа основа на животните и растенията. Ензимите са съставени изцяло или предимно от протеини.
Ензим катализа - каталитичните реакции се провеждат с участието на ензими - биологични катализатори на протеин природата. Ензимна катализа има две характеристики:
1. Висока активност. няколко порядъка по-висока от тази на неорганични катализатори, поради много значително намаляване на енергия активиране на процеса на ензим. По този начин, константата на скоростта на реакцията на разлагане на водороден пероксид, катализирано от Fe2 + йони. 56 е 1; постоянна скорост на същата реакция, катализирана от ензима каталаза, е 3,5 х 10 7 т.е.
Къде К м - Михаелис постоянна. числено равно на концентрацията на субстрат при υ = Уг υ макс. Константата Michaelis е мярка за афинитета между субстрат и ензим: по-малко да m. толкова по-голяма е способността им да образуват ензим-субстрат комплекс.

Фигура - 8.5 Зависимост на скоростта на ензимната реакция на концентрацията на субстрата
Характерна особеност на действието на ензими е много чувствителен ензимна активност на външни условия -
рН и температурата. Ензимите са активни само в сравнително тесни граници на рН и температура, ензимът се характеризира с наличието на този интервал максимална активност при оптимално рН и температура; от двете страни на тази стойност, ензимната активност намалява бързо.
За да се опише кинетиката на ензимни реакции, използвайки
Michaelis Menten уравнение (8.20).
Разглеждане на изхода на кинетичната уравнението за хомогенно каталитично процеса например реакция с изходен материал (субстрат) S. P който се превръща в продукта в присъствието на катализатор К (по-специално, като катализатор може да бъде ензим):
Физическата смисъла на това уравнение е, че при високи концентрации, всички прекурсор на катализатор, включени в съединение KS междинно съединение. Концентрация на СК достигне
гранична стойност С К 0. Следователно, скоростта на производство на
продукт достигне граничната стойност за дадено количество на катализатора, означен υ макс.

Лабораторни упражнения №1
Едно проучване на скоростта на инверсия на захар от захарна тръстика
Цел: Да се изследва степента на инверсия на захар от захарна тръстика и изчисляване на постоянен инверсия на скоростта на реакцията.
Инверсията на захар от захарна тръстика е киселинно катализирана хидролиза на захарозата, които се получават в резултат на прости захари: глюкоза и фруктоза. Тази реакция е широко използван в промишленото производство. Реакция уравнение има формата:
Тази реакция е практически необратимо, и неговия механизъм, както се вижда от уравнение, е бимолекулярен. Следователно eѐ скорост може да бъде изчислена от кинетичната уравнение:
Въпреки това, реакцията протича във воден разтвор, където концентрацията на вода е значително по-висока от концентрацията на захароза. Следователно, загуба на водни молекули в реакционната смес може да се пренебрегне и счита постоянна концентрация вода. след това
т.е. бимолекулна реакция всъщност е описан от кинетичната уравнение на реакция от първи порядък. Такива реакции са посочени nsevdonervogo поръчва реакции и константата на скоростта може да бъде изчислена съгласно уравнението
Молекули на всички захари, включително захароза, глюкоза и фруктоза съдържат асиметричен въглероден атом, което води до тяхната оптична активност и способността да въртят равнината на поляризация