водород молекула
Диаграмата показва образуването на водородни молекули. От двете 1S - орбитали на два водородни атома, имащи молекулни орбитали. Един сигма свързване σ1ssv. други сигма antibonding σ1srazr. Лепене орбитална е по-малка енергия, отколкото оригиналните атомна орбитала и antibonding по-голяма. Ето защо, електроните се движат с лепене на орбитална - виж фигури 7 и 8 ..
2 H (1s1) → H2 [(σsv.1s) 2] - 435 кДж
Намаляването на преход енергия на електроните с атомно да молекулни орбитали и позволява образуването на химични връзки и, съответно, молекулата на водород.
Фиг.7 образование молекулно орбитален на молекулата на водород
Фигура 8. Образуването на водородно свързване орбитален на молекулата
метод MO ни позволява да се обясни съществуването на йонна H2 +. Ако това се случи се образува един електрон се прехвърля на атомна орбитала на 1 и на свързващата орбитални σsv.1s че е благоприятно енергично и се придружават от освобождаването на енергия:
H (1s1) + Н + → Н2 + [(σsv.1s) 1] + 259 килоджаул
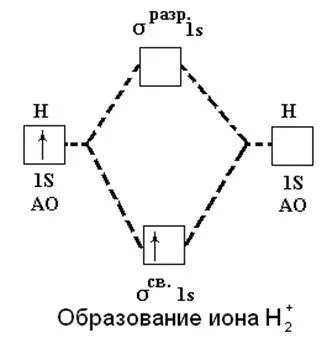
Фигура 9. Образуването на водороден йон
метод MO обяснява и защо не са там някои от частиците. Например, експериментално наблюдава молекулен йон НЕ2 +. От трите електроните в състава си две заемат свързване (σ1ssv.) 2 орбитален енергия е по-малко от първоначалното 1S орбитали и antibonding σ1s един разряд, източникът на енергия, която е по-голяма от 1 S орбити. В резултат на енергията на молекулен йон на хелий е по-малка от общата енергия на оригиналния атом и хелий йон, който определя възможността за неговото съществуване. Въпреки това, в молекула НЕ2 хелия, ако тя съществува, броят на електроните за лепене и antibonding орбитите на ще бъде същата и равно на две. Следователно, усилването на енергия в сравнение с общата енергия на двете хелиеви атоми не могат, поради тази причина съществува хелий молекули.