Термодинамика на електрохимична клетка
На галванични клетки (Фиг. 1) химична реакция на електродите се появяват по-бавно, отколкото голяма устойчивост има външна верига. По принцип, може да се затвори електрод проводник на безкрайно голяма устойчивост и реакцията ще продължи безкрайно бавно, така че във всеки един момент ще има баланс между електродите и разтвора. Такъв поток на реакцията е обратима. В случай на про-цесия термодинамично обратим получите максимална електрическа работата. Тя е равна на EMF елемент (Е), умножена по извършено зареждане. Ако реакцията протича за намаляване на времето и окисление на Z мола единично заредени йони, съгласно закона на Фарадей М. пробивът се прехвърля ZF, където F- Фарадей номер. Поддръжка на електрически съоръжения в изобарен-изотермичен процес се извършва за сметка на загуба на Гибс свободна енергия, така че - # 8710; G = zFE.Podstaviv този израз в уравнението на Гибс - Хелмхолц получи -zFE = # 8710; Хр -Т # 8710; старши Тъй като за р = конст и # 8710; G = -zFE, вземи
Производно наречен koeffitsientomEDS температура. В зависимост от естеството на клетката може да бъде положителен или отрицателен.
Уравнение (7), дава възможност да се изчисли teplovoyeffekt реакция, протичаща елемент vgalvanicheskom, чрез измерване на коефициента на едн и температура. За определяне на равновесната константа на тази реакция се използва уравнение
и Е 0 - стандартна едн когато средната активност на всички йони в разтвора са равни на един. От (8) следва, че
Ако активността на йоните, участващи в електрохимичната реакция, не са равни на един, след това да се прецени загубата на Гибс енергия вместо на уравнение (8) се използва уравнение изотерми
Например, за реакцията
От общия израз за едн на клетката
където Е ° - стандартна едн верига.
Тече химична реакция в клетката може да бъде разделена на две конюгирани реакции се провеждат в отделна poluele-Menten и. Съответно правителствени и изразяване на отделните електродни потенциали (# 966; и 1 # 966, 2) могат да бъдат получени с помощта на изотерма уравнения:
където # 966; 1 и # 966; 2 - стандартни електродни потенциали.
На метални електроди обикновено реакции от тип М + Z + Зе - ↔M.
В съответствие с тази реакция, и като се вземе предвид, че актив-ност твърдо вещество (метал) при дадена температура е постоянна и е равна на единица, изразът се получава за потенциала на електрода, по отношение на обратима метален катион:
Ако процесът включва tokoopredelyayuschem аниони, съгласно реакционната A + ZE - ↔a Z -. получаване на експресия на потенциала на един електрод, лечими по отношение на анион:
(Активността на окислена форма на аниона се взема като една единица).
Изразът за общия потенциал на електрода във формата на
Нернст е получен. Това уравнение показва, че потенциалът на електрода # 966; зависи от природата (характер се характеризира със стандартната капацитет # 966; 0), температурата и йонната активност в разтвора.
Standard потенциал # 966; 0 зависи от естеството на електрода и ха характеризира си електрохимична активност. За тази Ras-разтворител и температурата Целта на стандартната потенциал-триал количество е постоянна. абсолютна стойност # 966; 0 не може да бъде определена, като с помощта на волтметър за измерване само разликата потенциал-триал два електрода. Следователно, за да се измери # 966; 0 до елемент на стандартен водороден електрод (SHE), който потенциал обикновено се приема като нула при всички температури и тест стандартен електрод. BOO е показано на фиг. 2. Той се състои от платина плоча в спуснато разтвор на киселина с водороден йон активност на единство. Platinum ръка плоча е под газ водород ток се дава чрез налягане 1,013-10 5 Pa (1 атм) при постоянна температура.
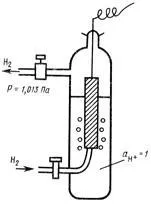
Фиг. 2. Стандартна водороден електрод.
Физическият капацитет на стандартна точка може да се настрои с помощта на уравнението
при което - потенциали електродните, - потенциал за контакт, - течност (дифузионно) потенциал.
Ако в това уравнение. електродвижещата сила клетката е стандартната потенциал електрод:
Това означава, че стандартната потенциал електрод включва против удар и незаписана потенциал дифузия, т.е.. Е. Съдържа неизмерима стойност и поради това не е абсолютно. Въпреки това, точно определя при стандартни условия на стандартната Gibbs енергията на окислително-редукционна реакция, която се извършва в електрода. Така стандартната потенциал (спрямо SHE) взема потенциала на електрода с йон активност равна на единица, при стандартни условия. защото # 966; щифт включени в стандартната потенциал на елек-trodes и # 966; диференциална сведе до минимум мощност в мост сол, изразът за EMF елемент под формата
Измерване на р = 1,013 • 10 5 Ра и Т = 298 К EMF елемент на BOO-стандартна мелница и електрода тестове, полу-chayut # 966; 0 на електрода за изпитване във вода-роден мащаб.
стандартни потенциали-Ly разположени в определен ред, за да образуват множество напрежения (водород скала).
Ако половината клетка, която включва две различни метал-ла, създаване на галванична клетка, толкова по разположен в електрохимичната серия сравнение с метал, разположен под ще има отрицателен потенциал. Когато изваждане на по-положителни потенциални повече отрицателни потенциали независимо от признаците риболов винаги получава положителна едн.
Познаването на стандартни потенциали на електрода може да се изчисли с потенциал за половината клетки на всички активни потенциални йони.
Обратимо работни елементи - тези елементи, в които, след отваряне на веригата за всеки електрод е установено равновесие. Обратимото реакцията може да се спре елемент чрез свързване на източник на външно захранване с една и съща стойност на електромагнитни полета, но противоположна посока. Ако увеличим външния източник на едн ток има малък размер, реакцията ще отиде в обратната-посока. Ако възникне преминаването на електрически ток в различни посоки по повърхността на електрод, същата реакция, но в противоположни посоки, тези електроди се наричат Obra-timymi. Пример за обратимо клетка е разгледаме по-рано Рени Jacobi елемент - Daniel, където, когато посоката на тока на реакция на Zn + Cu 2+ = Zn 2+ + Cu промени на борда. Електрод Cu | CuSO4 е обратим, тъй като
AC посоката на потока на реакцията Си2 + + 2е - → Cu 0 и Cu 0 -2Е - → Си2 +.
Ако процесът на отворена верига на електроди продължава etsya, и при смяна на посоката на електрически ток срещу-кабини, други реакции не обратен един до друг елементи са Xia необратимо. Един пример на елемент необратим схема е Волта
Където в процеса на експлоатация анод окисляване възниква цинк
и върху катода - процесът на възстановяване на водородни йони
Когато се прилага като елемент срещуположно насочени EMF, дори от безкрайно количество над EMF на елемента, електродите ще бъдат напълно различни процеси. Тъй като отрицателен електрод, който сега е в електролизата ще се нарича катода, редукционната реакция ще Н +.
2Н + + 2 д --- Н2. и по положителен (анода се разтваря в електролизата (и окислява)) мед
Според свойствата на веществата Операторът срещащи се в LAN-потенциални Определящи процеси, както и всички УСТРОЙСТВО stvu обратими електроди са разделени на следните групи: първата електродите и втория вид, редокс електроди и йонообменна.
1. електродите от първия вид. електрод водород газ.
Към електродите на първия вид включват метални електроди, обратими в сравнение с катиони и металоид, обратими по отношение на аниони. Обратимостта на електрод спрямо йон или други средства за неговата потенциална зависимостта на концентрацията на йони на данни. Примери на метални М-тип електроди | М + Z гледат състезанията-рано Zn ° | Zn2 +. Cu 0 | Cu 2+. Ag ¨ | Ag + и др. Електрода NY им потенциал даден от уравнение (10) и зависи само от концентрацията (активност) на един вид на метални йони. За електроди, обратимите относителните анионите прилага уравнение (11). Пример за металоид електрод обратим относителна-telno анион на селен може да служи като електрод Se | Se 2-.
Към електродите на първия вид включват също газ електроди, които могат да бъдат обратими по отношение на катион или анион. Те са създадени от схемата (метал) газ | разтвор. Металът в елек-trodes газ необходимо като носител на електрони и за създаване на повърхност, при която протича реакцията. Металът трябва да бъде инертен по отношение на вещества в разтвор. Ti-типичен пример е газ електрод водород елек-trodes (Pt) Н2 | Н +. Преди (Фиг.2) стан-дарт водороден електрод се изследва.
потенциал водороден електрод зависи от температурата, CON Центрация на водородни йони в разтвор и налягането на водорода върху повърхността на електрода. Ако реакцията на електрод протича 2Н + + 2е - → Н2. на
при което - парциалното налягане на водород на повърхността на електрод, приблизително равно на 1. Тъй като. на
Водороден електрод дава възпроизводим потенциална стойност. Недостатък е неговата голяма чувствителност към работните условия: степен изисква висока чистота водород, с активната повърхност разстояние платина отсъствието на окислители и розово заявителите в разтвора за изпитване.