термодинамична фаза
Термодинамична фаза - хомогенна част от хетерогенна система. ограничена от интерфейса, [1] [2]. По-малко строги, но по-ясно фази наречени "хомогенна част от системата, отделени от останалата част на видимите повърхности на раздела" [3]. По този начин хомогенна събиране на отделните части на системата с подобни свойства, се счита за една фаза (например, множество кристали на едно вещество или множество течни капчици. Суспендира в компонентите на газ и мъгла) [4]. Всяка фаза се характеризира с система състояние уравнение [3].
При преминаване през интерфейса поне една термодинамична собственост на промените на веществото с прекъсване [1] [5]. Често (но не винаги) интерфейсът е видима.
Хомогенна система съдържа само една фаза; хетерогенна система, състояща се от две или повече фаза [6]. System "лед - вода - влажен въздух" - трифазен хетерогенна. В различни фази на една система компонент може да бъде представен от различни агрегатни състояния или различни полиморфни модификации на твърдо вещество (орторомбична и моноклинна сяра. Грей и бял калай и др.) [1]. Броят на фази в хетерогенна система е предмет на правилото за фаза Гибс.
Фазата на система мулти-компонент може да бъде с различен състав и структура. Във всеки случай, наличието на фазовия преход означава възможност по принцип вещество от една фаза към друга. Многофазна токова система е в термодинамично равновесие, ако всички фази са механично. термична и фаза равновесие един с друг.
Газ винаги се състои от една фаза флуид може да се състои от множество течни фази с различни състави, обаче две различни течности на състава не могат да съществуват в равновесие (течен хелий, - изключение) (течен несмесващ liquation.). Веществото в твърдо състояние може да се състои от няколко фази, някои от които могат да имат същия състав, но различни структури (полиморфи, Алотропия).
Различните фази имат различни варианти на опаковане на молекули (за кристални фази с различни кристални решетки), и следователно, характерните стойности на коефициента на свиваемост, коефициент на термично разширение и други характеристики. Освен това, различните етапи могат да имат различни електрически (ferroelectrics), магнитни (феромагнитни) и оптични свойства (например, твърд кислород).
Термодинамична фаза на диаграмата на фазите
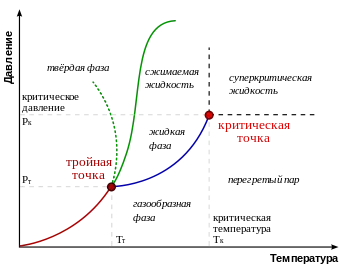
Типичните видове фазова диаграма. Зелена линия с точки показва необичайно поведение на вода
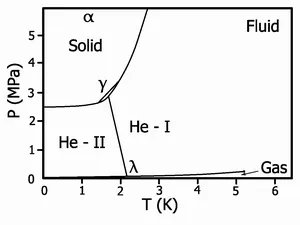
Диаграмата фаза на хелий-4
В диаграмата фаза от материал, различен термодинамична фаза заемат някои области. Линиите разделящи различен термодинамична фаза, наречени преходни линии фаза. Ако веществото е в съответна точка в рамките на регион, е изцяло в термодинамичен фаза. Ако състоянието на веществото съответства на точката на една от линиите на фазовите преходи, веществото в термодинамично равновесие може да бъде частично в един и отчасти в друга фаза. Делът на двете фази се определя, обикновено пълна енергия, съхранена система.
С бавна промяна в налягането или температурата на веществото е описано движи точка на диаграмата фаза. Ако тази точка в своето движение пресича една от линиите, които разделят термодинамична фаза, преходен фаза се случи. където физичните свойства се променят рязко вещество.
Не всички фази са напълно отделени една от друга с фазов преход линия. В някои случаи това може да прекъсне линията, която приключва на критична точка. В този случай, възможно постепенно, а не рязко преминаване от една фаза към друга, заобикаляйки линиите на фазовите преходи.
Точката на фаза диаграма където три линии на фазовите преходи, наречени тройна точка. Обикновено, тройната точка вещество се разбира специален случай, когато линията на топене събират, кипене и сублимация, но достатъчно богати фазова диаграма могат да бъдат повече тройни точки. Вещество на тройната точка в термодинамично равновесие може да бъде частично във всички три фази. На многомерни диаграми фаза (т.е. ако в допълнение към температура и налягане стойности настоящото различни интензивни) могат да бъдат кватернерни и други точки.
Термодинамични фаза и агрегатното състояние на веществото
Разположен на термодинамичните фази обикновено са много по-богат набор от обобщени състояния. което означава, че едно и също състояние на материята може да бъде в различни термодинамични фази. Ето защо този въпрос е описано от гледна точка на състояния на агрегация, а грубост, и то не може да се прави разлика между определени физически различни ситуации.
Богат набор от термодинамична фаза свързани, обикновено с различни изпълнения на реда. се оставя в определено състояние на агрегиране.
- Газовата вещество не притежава произволен ред. Съответно, всяко газообразно вещество има само една термодинамична фаза. (Фазови преходи на дисоциация или йонизация на молекулите са, по дефиниция, преходи на едно вещество в друга).
- Той има ориентировъчна реда на течността, но обикновено не е постъпателно ред. В резултат на това една и съща течност може да бъде различен термодинамична фаза, но броят им рядко надхвърля единство. Например, наличието на нова течна фаза открива в преохлажда вода. Друг пример - СУПЕРФЛУИД състояние в течен хелий.
- Кристално твърдо вещество тяло има и транслацията. и ориентировъчна цел. Резултатът е голям брой възможности за ориентация на съседните молекули по отношение един към друг, които могат да бъдат енергично изгодно под определено налягане и температура. Получените твърди вещества са обикновено доста сложен фазова диаграма. Например, фаза диаграма на тази привидно проста вещество като лед. Той има най-малко 12 термодинамичните фази реализирани при различни температури и налягания.
Изолацията Фаза - трансформация на хомогенна система в две или многофазен - широко използван в областта на науката и техниката.
Кристализация позволява да се получат чисти вещества.
може да се наблюдава под високо налягане феномен на разделяне в газовата система - газ. Възможното съществуване на хетерогенна равновесие на сместа газ над критичната температура, беше заявено по-Ван дер Ваалс. и след това явление се анализира чрез Камерлинг Онес и Keesom. Експериментално доказателство за това явление първо се получава от пример системата на амоняк - азот през 1941 година. Първоначално се предполагаше, че ограничената разтворимост взаимно се наблюдава само в газови смеси, съдържащи полярен компонент (амоняк. Сулфид). Въпреки това, беше установено впоследствие включените смеси хелий - въглероден диоксид. Хелий - етилен и хелий - пропан. Системният хелий - наличието етилен на интерфейса на ограничен взаимно разтворимостта на газовете се потвърждава чрез визуално наблюдение и фотографиране на менискуса между двете фази газове.
Когато снопа от газовата смес, понякога се наблюдава феномен т.нар barotropic - промяна поставя двете съпътстващи фази с нарастващ натиск. Например, в двойна система на NH3 (гр.) - N2 (г) фаза богати на амоняк, той има по-висока плътност. Въпреки това, когато снопа от сместа (90 ° С, 1800 атм (
1.84 Kbar)) фаза богати на амоняк вече има по-ниска плътност и се издига нагоре [7].