Силата на киселини и основи
Константите на киселинност и алкалност
Равновесната константа е количествена характеристика на силата на киселина или основа. Количествено киселинност, изчислена по отношение на водата. В същото време мярка за киселинност действа като реакция Константа на равновесие (рН константа) $ Ка $. За да се експресира $ А ↔ B + Н ^ + $ киселинност константа е равен на:
Стандартна равновесие има формата: $ H_3O ^ + ↔ H_2O + Н + ^ $, $ Ка = 1 $. След това за всяка киселина - основния процес:
$ A_1 + B_2 ↔ A_2 + B_1 $
В реакцията на киселина с вода или $ константи А $ равновесни съответстват на справочна литература дадените стойности:
$ A + H_2O ↔ H_3O ^ + + B ^ - $
за многоосновни киселини, последователно благоприятно няколко протони, първата киселинност константа е винаги по-висока от следващата;
oxoacids за ($ -ОН $ група, прикрепена към същия атом) $ pK_ $ обикновено по-голяма от $ pK_ $ до 5 $ $.
Стойностите $ $ PK_ за фосфорна киселина са $ 2,12 $; $ 7,21 $; $ 12,67 $ за $ аз = 1,2,3 $, съответно. Това означава, че във водна среда е доминиран от различен киселина - база баланс, в зависимост от рН на $ $.
Решете контрол по всички предмети. 10 години опит! Цена от 100 рубли. период от 1 ден!
Пишем евтини и точно навреме! Повече от 50 000 доказани професионалисти
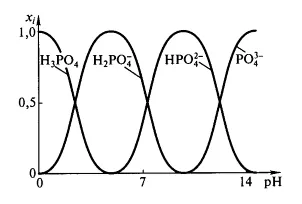
Фигура 1: Зависимост на относителното съдържание на фосфорна киселина йони различен от $ рН $
За малки стойности на рН от $ дял $ йон $ ^ _ $ 4 е много малка, но $ рН> pKa1 $ този йон започва да доминира. Протонирани йони, присъстващи главно в разтвор, когато рН $ $ е междинен между съответната стойност $ рКа $.Основно свойство постоянно се изчислява от съотношението:
Киселинността константа може да се дължи на алкалност постоянна връзка:
Колкото по-силна конюгатна киселина, свързана база на слабите. То отговаря на стойността на рК стойност - $ lgKa $.
Киселина се счита силно ако $ рКа
$ HA + H_2O = + A ^ - $ ще се почти до края и киселинните свойства се определят единствено от свойствата на $ H_3O ^ + $.
Основата е във воден разтвор на силна, ако $ рКЬ
РКА стойност от $ $ за слаби киселини са в диапазона $ \ СИМ 2-15,7 $.
autoprotolysis вода
Autoprotolysis водния баланс е както следва:
За тази реакция, термодинамично равновесие константа се определя експериментално. При температура от 298 $ \ K $ е равен на:
$ К = [H_3O ^ +] [ОН ^ -] = 1 \ cdot 10 ^ $
Това се нарича равновесна константа йонни продукт на вода Kw $. $
. Според теорията на протолитично реакция autoprotolysis константа на равновесие на вода е постоянна киселинност $ Ка (H_2O) $ Въз стойност $ Kw $, определена гама $ рН $:
Според Bronsted Теория - Lowry, соли, хидролизата може да се разглежда като специален случай на киселина - база равновесие. Хидролиза - обменният взаимодействието на йони с водата, протичаща от промяната на рН $ $.
Хидролизата на аниона, представено с формула:
Постоянното хидролизата $ $ Кр е постоянна алкалност на спрегнатата база на $ CH_3COO ^ -. $