Разглеждане билет № 21
Основните положения на теорията за електролитната дисоциация. Силни и слаби електролити. Постоянно и степен на дисоциация. Право на разреждане.
Практическо приложение на електролиза. Галванопластика.
През първата половина на ХIХ век. Майкъл Фарадей въвежда концепцията за електролити и не са електролити. Той призова електролити вещества, чиито водни разтвори провежда електрически ток, и които не са електролити - вещества, водни разтвори, които не осъществяват електрически ток.
За да се обясни свойствата на водни разтвори на електролити шведски учен S. Арениус (1859-1927) през 1887 г., той предложи теорията на електролитна дисоциация.
Според тази теория, когато са разтворени във вода, електролити разлагат в свободни йони. Този процес се нарича електролитна дисоциация. След разтвори на вещества са проводници на електрически ток, когато те съдържат йони (положително или отрицателно заредени частици), които в електрическото поле влизат в насочено движение.
Но тази теория не дава отговор на някои въпроси: защо някои вещества са електролити, а други не? Каква е ролята на разтворител до образуване на йони?
Възприемане на дисоциация на електролитите са разработени от българските химици И. А. Kablukova и В. А. Kistyakovskogo. Те прилага за обяснение на процеса на електролитно дисоциация теория на химически разтвори D. I. Mendeleeva. Както е известно, е експериментално доказано, че има химическо взаимодействие между разтвореното вещество чрез разтваряне електролити с вода, което води до образуването на хидрати и след това те се дисоциират на йони. Тези йони са свързани с водните молекули, т.е. те са хидратирани. Хидратираните йони в разтвор са в постоянен случаен движение. Ако този разтвор се поставя противоположно заредени електроди, положителните йони ще се движат към катода - те са наречени катиони и отрицателни ще се движат към анода - и следователно те се наричат аниони.
За да проникне в същността на електролитна дисоциация помогнали за установяването на характера на химичната връзка.
Електролити може да бъде само вещество с йонни и полярни ковалентни връзки. Вие знаете, тези вещества - това е солта, основи, киселини. Не забравяйте, определянето на класовете на тези вещества от гледна точка на теорията за електролитната дисоциация на.
S. Арениус за количествено характеризиране на електролитна дисоциация въвежда концепцията на степента на електролитната дисоциация, означен с гръцката буква а.
Степента на електролитна дисоциация - е съотношението на молекулите на електролитни разпадат в йони, общият брой на разтворените молекули.
Ако А = 0, веществото не се разпадат в йони, не е електролит. Той не включва електролити вещество с ниска полярност и неполярни ковалентни връзки, като например етери, въглеводороди, кислород, азот и други.
Степента на електролитна дисоциация може да има стойност от 0 до 1 (в проценти от 0 до 100%).
Силни електролити - са тези електролити, които във водни разтвори (дори концентрирана) почти напълно се разпадат в йони. Такова дисоциация степен на електролит тенденция 1 (100%). Като силни електролити включват почти всички соли, неорганични киселини (HNO3, НС1, HBr, HI, NClO4, NMp04, H2SO4), алкални (лъв, NaOH, КОН, Рон SsON, Са (ОН) 2, Sr (OH) 2, Ва (ОН) 2, Ra (ОН) 2).
Слабите електролити - това са електролити, които не се разпадат напълно в йони във водни разтвори. Тяхната степен на дисоциация е много по-малко от 1 (100%), в повечето случаи тя клони към нула. Но когато се разрежда, както може би си спомняте, степента на дисоциация се увеличава.
Слабите електролити включват много неорганична киселина (H 2 S, HF, Н2СО3, N2SiO3, NNO2, N2SO3), органични киселини, основи (с изключение на алкален), хидрат, амоняк NH3 • Н20, вода H2O, някои сол.
В разтвори на електролити слаби поради тяхната непълна дисоциация е установено динамично равновесие между недисоциираните молекули и йони. Например, за оцетна киселина: CH3COOH.
Равновесната константа на характеризиране слаб процеса на електролит дисоциация, посочена като дисоциационна константа. Константата на дисоциация описва способността на електролита (киселина, основа, вода), за да дисоциира в йони. Колкото по-голямо константата на дисоциация, толкова по-лесно електролита се разделя на йони, следователно, по-силен е. Константите на дисоциацията на слабите електролити са дадени в препратките.
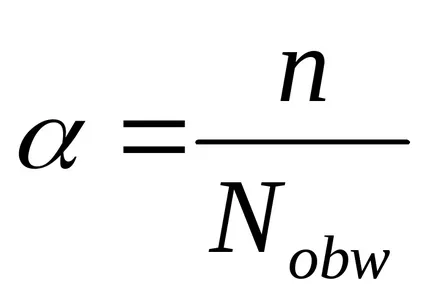
Средната 3 < <30 %
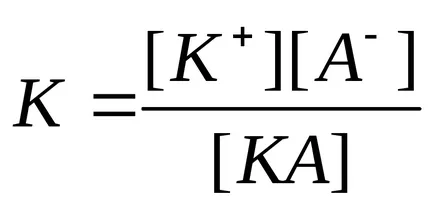
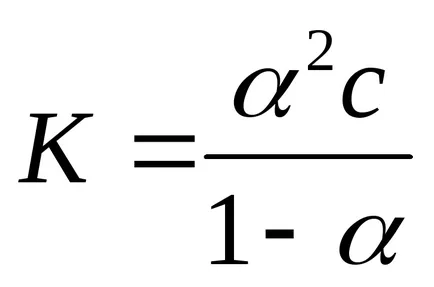
- право на разреждане
Използва се в промишлеността:
1. За метали (алуминий, магнезий, натрий, кадмий, получен само чрез електролиза).
2. За водород, халоген, основи.
3. За почистване метал - рафиниране (почистване на мед, никел, олово се извършва чрез електрохимична метод).
4. За защита срещу корозия метали - защитно покритие като тънък слой от друг метал, устойчив
Vågå корозия (хром, никел, мед, сребро, злато) -
галванични (фиг. 46).
5. Подготовка на метални копия от записите - галванични.
Галваника (от галванично. & Technology), областта на приложните електрохимията, обхващащ процесите на електролитно отлагане на метали по повърхността на метални и неметални продукти. Тя включва галванопластика и галванопластика. Разработен В. S. Yakobi (1838).
Галваника (от гръцки и галванично Stego - .. Покривки), метални покрития върху повърхността на метални и други статии от електролитно. Раздел галванопластика.
Electroforming (от гръцки и галванично plastike - .. скулптура) точни копия на метал чрез електролиза на метал върху метална или неметална оригинал. Раздел галванопластика.