Осмоза - един
(От гръцката. -tolchok, налягане), спонтанна миграция на островите през полупропусклива мембрана, разделяща два р-ра DEC. концентрация или чист р-erator и р-р. Naib. често има преход р-erator през полупропусклива мембрана непропусклив за разтваря количество. Спонтанно масообмен се появява в резултат на това химично вещество. р-erator потенциал намалява с увеличаване на концентрацията на разтвореното вещество в островите.
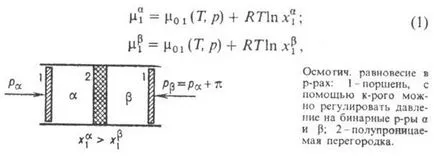
Разгледаме две двоични обем и г-RA (вж. Фиг.), Разделени от полупропусклива мембрана, проницаема молекула р-erator (компонент 1) и непропускливи молекули, разтворени в островите (компонент 2). Ако т-Т RA и RPO налягане от двете страни на преградата са едни и същи (Т = Т) и различни моларни фракции (), (Т, п)> (Т, Р). За идеален разреден или силно недвижими р-ров, където, оп. потенциал на чист р-erator, R- газова константа. Когато системата е термодинамично неравновесен и, следователно, има преход от обема на компонент 1 в обем, докато си част от мол в двете обеми са еднакви. За да се предотвратят масови концентрации трансфер и подравняване и спаси първоначален. съставът на двата р-позиция, е необходимо да се изравнят Chem. Компонент 1 потенциали от двете страни на вътр на промяна дял. условия (т-тура, налягане, вътр. Електрически. поле, в случая на р-ма електролити). Изотермичният. условия за запазване на фазовия състав на необходимостта да се промени налягането на един от р-рова. От термодинамиката е известно, че
където -partsialny моларно количество р-erator. За идеален разреден или много реален р-ров. където -molyarny обем на чист р-erator. Знак на производно е положителен и чрез увеличаване на налягането, приложено към р-RU, Chem. потенциала на р-erator ще се увеличи. Допълнителна. налягане. до-Roe следва да се прилага към р-Ру за да се предотврати влизането в своя окръг erator през полупропусклива мембрана на р-па, наречена. osmotich. налягане. При налягане на системата е в термодинамично равновесие:
Ако. равновесие е нарушена и има прехвърляне на р-erator на по-концентриран. R-ра по-малко концентриран. Това явление заглавия. обратна осмоза; Тя е широко практическо. прилагане на отделяне мембрана обработва в-а.
За идеален зависимост от р-ров osmotich. Налягане на състава изразена Ур-niem:
където налягане р -partsialnye-erator във фазите и. Ако фаза е нетната р-erator, г. F .. след това; Ур-комплект става известен като Ур зададена Ван Лаар:
От това следва, че osmotich. налягане R-ра LN x1 .Etoy пропорционално на големината пропорционално на намаляването на трет-RY замразяване и увеличаване на Т-RY кипене идеално р-ров (вж. закон на раул), която показва връзката между тези явления и О.
Ако концентрацията на разтворени острови сладък, зависимостта osmotich. Налягане от своя моларна концентрация 2> изразена Ур-niem Van't Hoff:
Това Ур-комплект обикновено се използва за изчисляване на osmotich. налягане двоичен р-ров в nedissotsiiruyuschih-ин. Въпреки това, най-доброто споразумение между изчислените и експериментални стойности в широк диапазон от концентрации. поле дава Ур зададена Ван Лаар (вж. таблица.). В методите и техниките osmotich измерването. см налягане. осмометрия.
Химическа енциклопедия. - М. съветски енциклопедия. Ед. I. L. Knunyantsa. 1988 година.