орбитална хибридизация
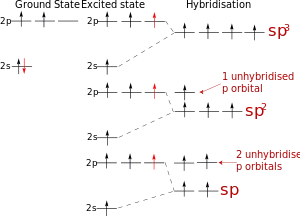
Схема хибридизация на атомна орбитала на въглеродни атоми
Концепцията за хибридизация на валентните атомна орбитала е предложен от американски химик Линус Паулинг да отговори на въпроса защо присъствието на централната атом е различен (S, Р, г) валентните орбитали, образувани в резултат на тях в многоатомни молекули с идентични лиганди са еквивалентни в своята енергия и пространствените характеристики ,
Възприемане на хибридизация са в центъра на метода на валентните връзки. Хибридизацията се не е истински физически процес, но само удобен модел, който позволява да се обясни електронната структура на молекули, по-специално хипотетичен модификация на атомна орбитала в образуването на ковалентна химическа връзка. по-специално, изравняването на дължините на химични връзки и връзка ъгли в молекулата.
успешно хибридизация концепция е приложена към качественото описание на прости молекули, но по-късно е разширена до по-сложни. За разлика от теорията на молекулни орбитали не е строго количествено, например, не е в състояние да се предскаже фотоелектронна спектри дори прости молекули, такива като вода. Понастоящем се използва предимно за методологични цели и в синтетичната органична химия.
През 1954 г. Нобелова комисия чест L.Polinga награда по химия "за изследвания на естеството на химичната връзка и неговото приложение за обяснението на структурата на сложни молекули." Но той не беше доволен въвеждане L.Poling на σ, пи - Описания на двойна и тройна връзка и спрегнати системи.
През 1958 г. на симпозиум, посветен на паметта на Кекуле. Полинг разработи теория извити химическа връзка. като се вземе предвид Кулон отблъскване на електроните. Според тази теория, двойната връзка е описан като комбинация от две извити химични връзки, и тройна връзка като комбинация от три извити химични връзки. [1]
Този принцип е отразено в теорията на електронна двойка отблъскване Gillespie - Нихолм, първият и най-важното правило е формулиран, както следва:
"Електронни двойка получаване на място на валентността обвивка на атома, в който те са максимално разстояние една от друга, т.е. електронни двойки се държат като че ли са взаимно отблъснати" [2].
Второто правило е, че "всички електронни двойки, принадлежащи на електрони обвивка валентността, се счита, че се намира на същото разстояние от ядрото." [2]
SP-хибридизация

Това се случва, когато се смесват аудио s- и р-орбитали аудио. Създадена два еквивалентни атомна орбитала SP-подредени линейно под ъгъл от 180 градуса и насочени в различни посоки от централната ядрото на атома. Останалите две нехибридни р-орбитите са разположени взаимно перпендикулярни равнини, и са включени в образуването на я-връзки или несподелени електронни двойки, участващи.
SP 2 -hybridization
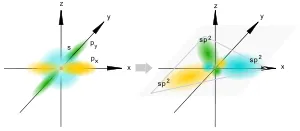
SP 2 хибридизация
Това се случва, когато смесване на два аудио s- и р-орбитали. Три хибридни орбитали са оформени с оси, разположени в една равнина и насочени към върховете на триъгълника под ъгъл от 120 градуса. Нехибридни р-атомен орбитали перпендикулярни на равнината, и са включени обикновено в образуването на я-връзки
SP 3 -hybridization
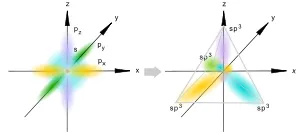
SP 3 хибридизация
Това се случва, когато смесване аудио три S- и р-орбитали, образуващи четири еквивалентни по форма и SP 3 -Hybrid енергия орбитален. Могат да образуват четири а-връзки с други атоми, или напълнени с самотен двойки електрони.
Оси SP 3 -Hybrid орбитали са насочени към върховете на тетраедър. докато сърцевината на централната атом се намира в центъра на окръжност областта на тетраедъра. Ъгълът между всеки две оси, приблизително равна на 109 ° 28 '[3]. която отговаря на най-ниската енергия електрон отблъскване. Също така SP 3 орбитали могат да образуват четири а-връзки с други атоми, или напълнени с самотен двойки електрони. Такова състояние е типично за въглеродни атома в наситени въглеводороди и, съответно, в алкиловите радикали и техните производни.
Хибридизацията и геометрия на молекули
Идеята за хибридизация на атомни орбитали са в основата на теорията за електронна двойка отблъскване Гилеспи-Нихолм. Всеки тип на хибридизация съответства строго определена пространствена ориентация хибридни орбитали на централната атом, което позволява използването му като основа стереохимични представителства в неорганична химия.
В таблицата са посочени най-често срещаните примери за видове съответствие хибридизация и геометрична структура на молекулите на предположението, че всички хибридни орбитали, участващи в образуването на химичните връзки (няма несподелени електронни двойки) [4].
номер
хибридни орбитали
- ↑ Редактирано от R. Н. Freidlin. Теоретично Organic Chemistry. - транс. от английски език. СТАНИСАВЛЕВИЧ. Chem. Yu.G.Bundelem науките. - М. Издател чужда литература, 1963 - В. 1. - П. 11. - 365 а.
- ↑ 12Gillespi R. геометрия молекули / Trans. от английски език. EZ Zasorina и VS Mastryukova, изд. Yu. А. Pentina. - Мир, 1975 - П. 18-19. - 278 с.
- ↑ Теоретично, този ъгъл на редовен тетраедър е ARccOS (-1/3) ≈109 ° 28 '.
- ↑ където А - централната атом, X - свързване хибридни орбитали
- През оригиналната му описателна е медия, свързани с орбиталната хибридизация
- Анимираните изображения хибридизация