Определяне на електрохимичната еквивалент на мед
Лабораторни упражнения №14
Цел: Научете се как да се определи емпирично електрохимична еквивалент на мед.
Теоретично: процесът, чрез който молекули соли, киселини и основи, когато са разтворени във вода или други разтворители разтварят на заредени частици (йони) се нарича електролитна дисоциация; където полученият разтвор с положителни и отрицателни йони, наречен електролит. Ако плавателният съд се поставя с плочи електролитни (електроди), свързани към клемите, източник на ток (създаване на електрическо поле в електролита), на положително заредени йони ще се движат към катода, докато отрицателното към анода. В електродите настъпва реакциите на окисление намаляване, където електродите са разпределени вещество реакционни продукти.
За електролиза право Фарадей е валидно: маса на освободен вещество в електрода е пряко пропорционална на заряд Q на преминава през електролита: m = QK или m = IKT, където К електрохимична еквивалентно количество вещества, извлечени по време на преминаването на електролит през една висулка електроенергия. За всяко вещество К- стойност е постоянна. Чрез измерване на ток в електрическата верига, съставена съгласно схема, тъй като преминава и маса освободен в катод материал може да се определи електрохимичен еквивалент. От Фарадей право 1 Kx (т) = мм / е (кг / KL)
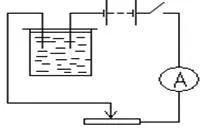
Оборудване: 1. източник на електрическа енергия (слънце токоизправител - 4-12 или акумулаторна батерия 2. медната плоча (2 части), 3. електролитна вана с разтвор на меден сулфат 4. амперметър 5. ключ 6. свързващи проводници 7. скала и. тегла; 8. реостат; 9. часа 10. фен или печка таблица 11. шкурка.
1) старателно пречиства повърхност на шкурка медна плоча претегля по скалата на възможно най-точно.
2) Съберете електрическа верига, както е показано на фиг. А претеглената плоча свързан към отрицателния полюс на електрическа енергия източник.
3) След проверка учител верига забелязал по време на часовника с втора ръка, за да затворите ключа. Настройте бързо реостат ампераж 1-1,5 А. С помощта на реостат, за да се поддържа силата на тока, постоянна по време на експеримента.
4) След 8-10 минути отворена верига. Плаката служи експеримент катод, отстранява внимателно се промива с вода, суши преди или фен-плочи, и внимателно претеглени за определяне на теглото на утаения мед.
5) Резултатите от измерванията за определяне на електрохимична еквивалента от мед.
6) сравнение на получената стойност, равна електрохимична мед и табличен да се определи грешката относителната измерване.
7) Резултатите от измерването са написани на масата.
катодна маса за opytamK кг
катодна маса след opytaMMK кг
KX = тМ / е = 2 х 10 -3 / 0,7 х 900 = 3174 х 10 -7 кг / C
= 3,174 х 10-7 -3294 х 10 -7 / 3,294 * 10 -7 х 100% = 3.6%
1) Защо молекула киселина алкална сол във вода и се разпадат в йони?
2) Защо е повишаване на температурата на електролита съпротивление намалява?
3) Ще има електрически дисоциация в космически полет?
4) При какви условия концентрацията на електролита в процеса на електролиза не променя?
5) Какво трябва да направя, ако по погрешка, когато опитът на тегло плоча, катодът е свързан към положителния полюс на източник на ток?
6) Как така, когато е необходимо да се запои проводник към електрода въглеродния?
Отговори на тестови въпроси.
1) Тъй като молекулата на водата е дипол и могат да се простират йоните на тези вещества.
2) устойчивост електролит намалява с повишаване на температурата, тъй като се увеличава скоростта на йоните, носители на заряд мнозинство в електролити.
3) Да, електролитна дисоциация в пространството се извършват полети.
4) При условие, че анодът се освобождава в разтвор същия метал колкото е депозиран в катода и газ не се освобождава по време на електролизата.
5) Необходимо е от първоначалното тегло на анода се изважда теглото му след електрохимичната дисоциация. Така че можете да разберете колко мед е изчезнала от пластината в разтвор, и тази маса, равна на масата нанася върху мед катод.
6) Използване на електрохимичната дисоциация депозиран на въгления електрод, който - или метал, и след това да спойка проводник към него.
Заключение: Аз разбрах, за да се определи електрохимична еквивалент на мед.