Определяне на електродни потенциали на метали
физика и технология на оптична комуникационна
Лабораторна работа №5
ОПРЕДЕЛЯНЕ НА МЕТАЛИ електродни потенциали
Определяне на електродни потенциали на Cu, Pb, Zn, Fe, Ni. За проучване на изменението на електрод потенциал на цинк, в зависимост от концентрацията на разтвора на цинкова сол.
Всеки метал има разтворимост в електролита, макар и незначително. Ако металната плоча потопен, например във вода, металните йони в резултат на тях полярни молекули вода може да излезе от повърхността и отиват в съседния слой на вода; така че преди неутрален атом се превръща положително зареден йон:
Процесът е динамичен характер, така че в електролита в металната повърхност за създаване на преразпределение концентрации на йони на разтворител и метални и молекули на разтворителя.
По този начин, взаимодействие на метала с вода или разтвор, съдържащ йони на метала, в резултат на образуването на повърхността на електрическата двоен слой и външния вид на потенциална разлика между метала и разтвора. Тази потенциална разлика включва потенциален спад в слоя на адсорбирани на повърхността йони (JA) и потенциалния спад в разтвора (в дифузия слой (Jd):
Преход метални йони в разтвор - обратим процес и изотермични, тук системата прави максимално полезна работа А. характеризира изобарно-изотермично потенциал Gibbs DG ° р:
където п - заряд йон; й - потенциалната разлика между метала и разтвора, F - броят на Фарадей.
Равновесието е динамичен: слой част повърхност йони дифузно в електролита, други йони от разтвора ги замества. В резултат на равновесната концентрация на метални йони при C0 на повърхността на електрода е различен от средната концентрация на йони в разтвор В.
Изотермична операция за преместване на йони между 1 мол и количеството на повърхностен слой на разтвора се определя като:
От условието, че тези произведения трябва да бъдат:
От тук може да се намери потенциала на електрода:
определи експериментално възможно концентрация С0, така че потенциалът на изолирания електрод потопен в разтвора на електролит, не е възможно да се изчисли. Въпреки това, може да се определи разликата в потенциала (едн = DE = J2 - J1) между същите електроди, потопени в разтвор на собствените йони, но с различни концентрации, така наречената клетъчна концентрация:
или за стандартни условия (298 К), и след замяна на натуралния логаритъм на знак:
Електрохимията на метал електрод обикновено се измерва потенциал във волтове, означена Е, по отношение на стандартен референтен електрод, който потенциал обикновено се приема като нула. Чрез международен договор, като сравнителен електрод, се използва стандартен водороден електрод. условен количество характеризиране на възможността на електрода под внимание, са като ЕДС на клетката, състоящ се от този електрод и стандартен водороден електрод. Това количество се нарича потенциала електрод на електрода и е означен с писмо Е о. По този начин, като концентрацията на метални йони в адсорбирания слой С0 = 1 мол / л, ние получаваме EMF елемент, съставен от един вид метал, но при различни концентрации на йони в разтвор:
където СМез п + - моларна концентрация на йони.
Това уравнение се нарича уравнение на Нернст.
Уравнението е приблизителна, тъй като не се вземат предвид йон-йонна взаимодействие в електролитни разтвори. инжектира йон активност, свързана с неговата концентрация след уравнение за отчитане на това взаимодействие:
където е - коефициент активност.
Уравнението за изчисляване на потенциала на електрод също има следния вид:
Редът на изпълнение
Работа провежда в два етапа: първи етап се измерва стандартни електродни потенциали на метали, когато е потопена в разтвори на съответните соли с концентрации от 1 мол / л; във втория етап на зависимостта на потенциала на електрод на метал (цинк) чрез потапяне в цинкова сол разтвори с различни концентрации: 0.1 М; 0,5 М; 1.0 М и 1.5 М.
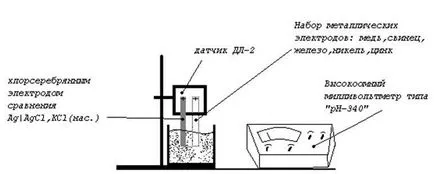
1. Вземете набор от електроди.
2. Преди измерванията всеки път да ивица шкурка повърхност електрод.
3. Последователно изследвани електроди, свързани към сензора, като веригата на галванична измервателен електрод и сребърен хлорид. Двата електрода по този начин трябва да се доставят в подходящ сол разтвор на желаната концентрация.
4. Инструментът ще определи ЕВФ.
5. изчисли стойността на измереното напрежение (DE) в тУ. За тази цел устройството за четене Полученото умножено по 100.
6. След всяко измерване сребърен хлорид електрод трябва да бъде потопен в дестилирана вода.
Извършва експерименти и извършване на необходимите изчисления, установихме електродните потенциали на мед, олово, желязо и никел, и също учи промяна на капацитета на електрода цинк в зависимост от концентрацията на разтвора на цинкова сол с нашия грешка е от 15% до 24% поради дефектен почистване електрод преди всяко измерване.
Също така ние открихме някои различия по теория и практика:
С увеличаване на концентрацията на цинк повишен потенциал електрод
Още по темата
Информация за работата
Доклади за лабораторна работа
За да отпечатате файла, да го изтеглите (в Word формат).