Методи за получаване - studopediya
1. Хидролиза galogenproizvodnyh:
2. Намаляване на ароматни алдехиди:
3. Реакция Konnitstsaro. Действието на смес от два алдехиди концентриран разтвор на алкален до получаване на алкохол и киселина:
4. Синтез на ароматни въглеводороди и окиси с алуминиев хлорид като катализатор:
Химични свойства и приложение. Алкохоли с хидроксилна група в # 945 - позиция лесно реагира gidrogalogenirovaniya (SN):
Алкохоли с хидроксилна група в # 946 - позиция лесно дехидратиран (Е):
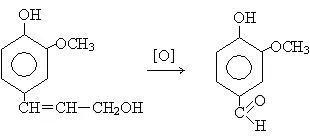
Бензилов алкохол като естери на оцетната и бензоени киселини, използвани в парфюмерията. Естерите на бензилов алкохол и канелена и бензоени киселини са част от природни масла, балсами, защото миризмата на жасмин, зюмбюл, тубероза.
# 946, намерено в розово масло -feniletilovy алкохол се използва в парфюмерията, като стабилизатор миризми.
Феноли - хидрокси молекули, в които хидроксилните групи са свързани директно към бензеновия пръстен.
Феноли в зависимост от броя на хидроксилните групи са разделени на едно-, дву-, тривалентни и поливалентен:
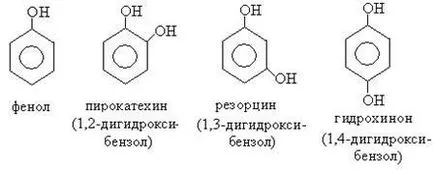
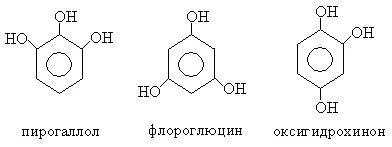
Феноли или са тривиални имена, или те са известни като заместен бензен.
Фенолни структура под формата на глюкозиди включени в растителна тъкан.
Методи за получаване. Съществуват няколко метода за въвеждане на хидроксилна група в ароматния пръстен. Някои от тях имат индустриално приложение:
1. сливането на натриеви соли на сулфонови киселини с основи:
2. От Тар производство течност кокс.
3. Хидролиза на халогенни производни. Техниката на фенол, получен в добър добив от hlobenzola. Процесът се провежда при строги условия, като хлор, свързани с ядрото е неактивен:
4. оксидативен декарбоксилиране на карбоксилни киселини:
5. съвместен процес за получаване на фенол и ацетон (Метод Sergeev Kruzhalova-Nemtsova):
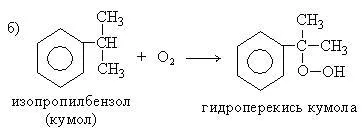
6. Получаване на амини от фенол чрез диазотиране (Sandmeyer реакция):
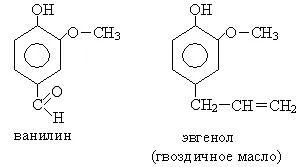
7. фенолни производни са част от етерични масла:
Химически свойства. Основните реакционни центрове в фенол е хидроксилна група и ароматен бензенов пръстен. Следователно типичните реакции са:
- реакцията на хидроксилна група;
- електрофилно заместване в бензеновия пръстен.
I. Взаимодействието на хидроксилна група.
1. киселина базови свойства на фенол. Киселинните свойства на фенол (т.е. способността да отдаде протон) експресират значително по-силни от алкохол. Този ефект се дължи на електронни свързващи двойки кислород в фенол с ароматен бензенов пръстен. Получената отрицателен заряд на кислородът е много по-малък и протон лесно се разкъсва. В алкохоли това не се наблюдава, така че фенол също наречен карболовата киселина.
Високата киселинност на фенола му позволява да взаимодейства не само с активните метали, но също и с хидроксиди на алкални метали.
2. Взаимодействие с galogidnymi алкини:
3. Взаимодействие с хлорооцетна киселина:
4. Взаимодействие с киселинни хлориди:
5. Взаимодействие с анхидриди на карбоксилни киселини:
II. Electrophilic заместителни реакции в бензеновия пръстен.
Взаимното влияние на атомите в молекулата на фенол се проявява не само в поведението на хидроксилни групи, но също така по-реактивност на бензеновия пръстен. Хидрокси групата увеличава електронната плътност на бензеновия пръстен, особено в позициите орто и пара (М + -effect ОН групи);
следователно значително по-активен от бензол фенол реагира електрофилно заместване (SE) на ароматния пръстен.
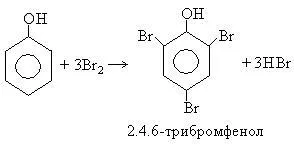
1. халогениране. Фенол лесно при стайна температура, взаимодейства с бром води до образуване на бяла утайка от 2,4,6-tribromophenol (качествен отговор на фенола):
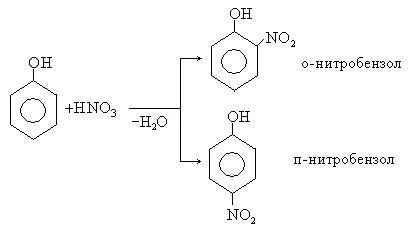
2. нитриране реакция. Под действието на 20% фенол азотна киселина лесно се превръща в смес от орто- и пара-нитрофеноли. Изомерните нитрофеноли лесно разделени дължи на факта, че само изомера орто е летливо с пара. Високата степен на променливост на орто-нитрофеноли обяснява с образуването на вътрешномолекулни водородни връзки.
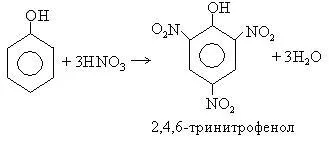
Използването на концентрирана HNO3 образува 2,4,6-тринитрофенол (пикрикова киселина)
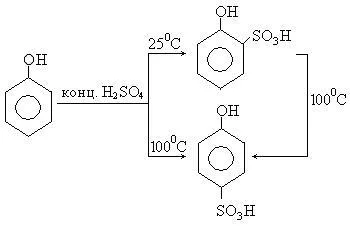
3. сулфониране на феноли получава о - и р -fenolsulfokisloty. При стайна температура, концентрирана сярна киселина дава главно за изомер, докато при 100 ° С 0 р изомера преобладава. Изомерите се разделят поради различната разтворимост на бариев сол:
Използването на фенол и неговите производни. Фенол - кристално вещество има антибактериално, дезинфекционни свойства и се използва озаглавено карболовата киселина в медицината. Фенол прави дълбоки и тежки изгаряния по тялото му. Използвани за производството на фенол-формалдехидни смоли:
Фенол-формалдехидни смоли, се наричат също бакелит. При провеждане на полимеризацията novolochnye смоли се получават при киселинни условия, които се характеризират с линейна структура, където кондензацията се среща в орто позиция на фенола. В алкална среда, получена резол характеризира с омрежващо молекули на орто и пара позиции. Тази кондензационна реакция е реакция на електрофилно заместване на електрофилно въглерода на карбонилната група се подава алдехид.
Феноли като гликозиди широко разпространени в природата, например, арбутин, който се съдържа в листата и семената на круша. Ензимната хидролиза на арбутин, хидрохинон се образува, която чрез окисление дава специфичен черно. Това обяснява и потъмняването на листата в есенни круши.
Фенолни съединения са част от лигнин, и съдържат почти всички растения. кората на дъб съдържа до 20% фенолни съединения. В чест на това растение, който е един от първия и сравнително богат източник на фенолни съединения, те са наречени танини. Букет възраст коняк е причинена от окисление на производно фенол - кониферил алкохол ванилин, който информира характеристика аромат.
Фенолни фрагмент влиза в състава на антоцианин - структурите, които водят до богата цветова палитра от различни цветове. В зависимост от естеството на радикалите R1 и R2 цветове могат да бъдат различни.
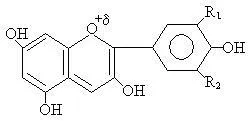
- Цианидин (метличина цвят)
Фенолни структури са част от танините (галова киселина се съдържа в кората на дъб и върба). Стипчивостта дължи на наличието на чай катехини.
Двувалентни феноли се използват като антиоксиданти. Механизмът на действие е както следва:
Фенолни антиоксиданти са широко използвани в хранително-вкусовата промишленост, за да се предотврати развалянето на мазнини, масла и кремове. Най-често срещаните сред тях са:
2-трет-бутил 3-трет-бутил-2, 6- ди-трет-бутил
4- метоксифенол 4-метоксифенол 4 - метоксифенол