Методи за получаване на золове
Хидрофобни золове получават 2 методи:
I диспергиране метод или дисперсия (смачкване);
Метод II кондензация (разширяване).
диспергиращи методи, извършвани от механични, електрически или ултразвукови смачкване вещества колоиден размер на частиците. За тази цел се използват специални колоидни мелници.
методи на кондензация се основават на прехода и молекулярния йон в колоидни разтвори чрез образуване на слабо разтворими вещества от химични реакции или физически промени в околната среда.
Чрез кондензация методи включват:
1) химични методи (хидролиза, двойно реакция обмен, окисление-редукция);
2) методи за обмен на разтворител, когато средата на дисперсия, в която дисперсната фаза образува разтвор молекулно съединение се заменя със среда, в която неразтворимо вещество.
Получаване на золове от химически кондензация
4 FeCl3 + 3 k4 [Fe (CN) 6] = Fe4 [Fe (CN) 6] 3 + 12 KCL
2) Хидролиза на сол: FeCl3 + 3 Н 2О = Fe (ОН) 3 + 3 HCl
При получаването на золове чрез химическа кондензация на следните условия:
1) золове приготвят чрез смесване много разредени разтвори на реактивите (например, с Agl), като при по-високи концентрации на утаяване, оформен в еквивалентни количества;
2), необходими за получаване на зол стабилизатор. Когато химични методи за получаване на колоидни системи действат като стабилизатор на реакционните продукти.
Структурата на колоидните мицели разгледа структурата на мицелите в излишък с Agl ки:
Ако една от изходните материали, взети в малък излишък, той служи като стабилизатор, т.е. придава резистентност с Agl колоидни частици. Колоиден частиците има сложна конструкция и се състои от блок (набор от голям брой молекули). Йоните I - ще продължат да завърши строителството на единица решетка, което му електрически заряд. Това йон потенциал наречената йон (ПРИ). След това се започва борба с адсорбирания К + (АТ). Основната част от противойони адсорбирани върху основната колоиден частиците, образува заедно с пой адсорбирания слой и част от противойони (10%) отива в обема на разтворителя и образуват дифузен слой.
Схематична структура на мицелите AGI на KI излишък се изрази както следва:
. п I ~. (N - х) K +> х ˉ. х К +
единица, когато дифузно пой
Колоиден частиците слой дифузно форми мицел: m - брой молекули на сребърен йодид в ядрото
п - брой потенциални Определящи йони I ~
(N - х) - брой свързани противойони К +. включени в адсорбционната слой
х - броят на К + йони. включени в дифузен слой.
Коагулация на lyophobic золи
Коагулация - процес на консолидация на колоидни частици от адхезия под влиянието на молекулните сили на привличане.
Този процес позволява наличието на колоидни частици като такси. За да причини коагулация на Сол, че е необходимо да се неутрализира заряда на колоидни частици, след което частиците ще се сблъскат и се държим заедно. Коагулация на зола може да бъде достъпен по различни начини, най-лесно с помощта на електролити.
Когато золове коагулация от електролити е компресия дифузия слой, който позволява на колоидни частици да се приближават един към друг на разстояние, което е вече действащи сили на междумолекулна привличане.
Разграничаване коагулация стъпка 2: скрит и очевидно. Когато изрично коагулация зол оцветяване варира поради загрубяване на частиците, се появява помътняване и допълнително утаяване настъпва - без агрегати на колоидни частици, установяващи от гравитацията.
За очевидно възникване на коагулация на концентрацията на електролита трябва да бъде равна на или по-голям от коагулацията на прага зол.
На коагулация на способността на електролити характеризиращ праг коагулация (γs), т.е. минималната концентрация на електролита в милимола за 1 литър зол, при която започва коагулация ясно. Свържи се с праг коагулация стойност нарича коагулация действие (1 / γs).
Коагулация на действие има само един електролит йон, който има заряд обратна на заряд на колоидни частици.
Например, на положително заредена зол на железни хидроксидни аниони упражни коагулация действие, но от отрицателно зареден зол Fe4 [Fe (CN) 6] 3 (пруско синьо) - катиони.
Коагулация на способността на йони е по-голяма, толкова по-висока валентност.
ПРАВИЛО Schulze-Gard (обикновено валентност) състояния на +2 електролитни йони коагулиращи ефект има един знак, който е противоположен на заряд на колоидни частици, и този ефект е по-силен, колкото по-висока валентност на коагулация йон.
Връзката между прага на коагулация (γs) и валентност (Z) коагулация йон изразява чрез уравнение:
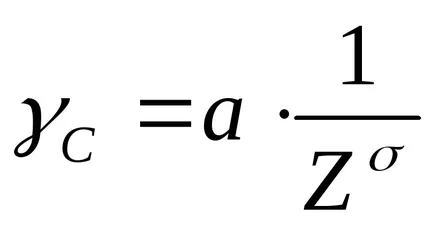
където γs - праг коагулация
и - фактор на пропорционалност.
Според теорията на Derjaguin, коагулация на прага е обратно пропорционална на йонна валенция за коагулация на шестата степен:
6. Въпросите за самопознанието:
Запис формула мицели золове получени чрез обменни реакции:
а) с излишък на CaCl2;
Какво коагулатор електролитни йони ще коагулират зола: K +. Na +. Са2 +. Ci-, Al 3+. [Fe (CN) 6] 3 ~ [Fe (CN) 6] 4 ~? Подреждане на избрани йони в серия лиотропна.
Определяне на което електродът трябва да се движат золни частици, получени чрез реакция с лек излишък на Н2 S: