Ковалентното неполярен и полярни връзки
Общата електронни двойки, произведени в прости вещества 2. О 2. Н Cl F 2. 2. 2. N еднакво принадлежат към двата атома. Това се нарича неполярен ковалентна връзка.
Неполярен ковалентна връзка свързва атомите в прости вещества не-метали.
Ако се образува ковалентна връзка между различните атоми, общите електронна двойка отмествания на този, който има по-висока Електроотрицателност (ЕО). Той получава частичен отрицателен заряд. Атом, имащ по-малък ЕО става на заредена положително. В този случай, полярен ковалентна връзка.
Полярен ковалентна връзка е образувана между неметални атоми в комплексните вещества.
Помислете за образуване на ковалентни връзки в сложни вещества.
1. Образуването на хлороводород молекула
В водороден атом върху външната ниво, един електрон. Хлор външно седем електрон, един несвоени.
Създадена обща електронна двойка, което се компенсира с хлорен атом. В резултат на това
частични такси показват: атом хлор отрицателен и водороден атом, - положително. преминаването на електронната плътност обикновено се означава с гръцката буква делта делта:
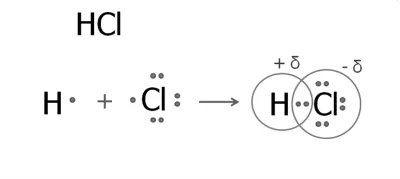
Хлорид структурна формула Н - Cl.
Също свързан атома в молекулите на други халиди:
Н - F Н - Br H - I
2. Получаване на водна молекула
Външно, шестте електроните от кислороден атом, две от които са несдвоен.
кислороден атом образува два споделени електронни двойки с два водородни атома.
Плътността на електрон на тези общи двойки изместен към по-електроотрицателна кислород. кислороден атом има отрицателен заряд и водородните атоми - положително.
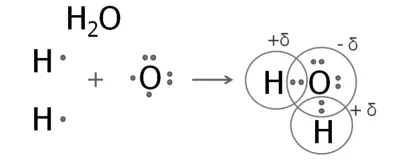
Подобна структура е сероводород молекула. Структурните формули на вода и сероводород:
Н - О Н - S | | Н Н
3. образуването на амоняк молекули
В азотен атом пет външни електрони, от които три несдвоен.
Азотният атом се свързва с три водородни атома.
Азотни - повече електроотрицателна елемент, така че ще бъде отрицателен заряд атом и водородни атоми - положителни заряди.
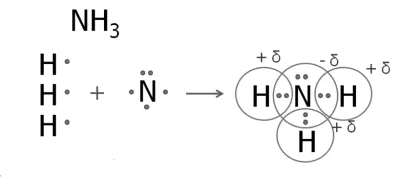
Той също така се произвежда в резултат на фосфин. Структурните формули на амоняк и фосфин:
Н - N - Н Н - Р - Н | | Н Н
За да се определи частичните признаци на обвиненията на атомите в материала, че е необходимо да се сравнят EA неметали.
Ние дефинираме частични заряди на атоми в съединението С Cl 4.
Припомнете си позиция въглерод и хлор сред ЕО:
F O N Cl Br S С
Позицията на елементите в този ред показва, че по-електроотрицателна елемент е в тази двойка хлоро. Атом, тя се изтегля към общите електронни двойки от въглеродни атоми. Това означава хлорен атом е частичен отрицателен заряд при въглероден атом и - частичен положителен:
C + δ Cl 4 - δ