Класификация на химични реакции в органична и неорганична химия, ЕГЕ в Chemistry
Класификация на химични реакции в органична и неорганична химия
Химическите реакции или химични явления - е процес, в резултат на което се образуват някои от другите вещества, които се различават от тях по структура и (или) структура.
Когато химическите реакции, необходими за промяна на веществата, в която са оформени разкъсване стари и нови връзки между атоми.
Химични реакции трябва да бъдат разграничени от ядрени реакции. В резултат на химична реакция, общият брой атоми на всеки химичен елемент и неговите изотопен състав не се променят. Друго значение на ядрената реакция - трансформация процеси на атомните ядра като резултат от техните взаимодействия с други ядра или елементарни частици, например магнезиево-алуминиев превръщане до:
Многообразно класификация на химични реакции, т.е. Различни функции могат да бъдат пуснати в своята база. Въпреки това, при някои от тези характеристики могат да бъдат класифицирани като реакцията между неорганични и органични материали между.
Помислете за класификация на химичните реакции по различни причини.
Класификация на химичните реакции за броя и състава на реагентите. Реакциите ще без да се променя състава на веществото
В неорганична химия за такива реакции включват получаването обработва алотропна модификации на химичен елемент, например:
В органичната химия за този тип реакция може да бъде по изомеризация реакции, които излизат без да се променя не само качествено, но и количествен състав на молекулни вещества, например:
1. Под изомеризация на алкани.
Изомеризация на алкани е от голямо практическо значение, тъй като разклонени въглеводороди, имат по-ниска способност за детонация.
2. изомеризация на алкени.
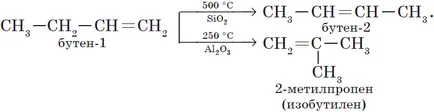
3. Изомеризация алкини (А. Е. Favorskogo реакция).
4. Изомеризация халоалкани (А. Е. Favorsky).
5. Изомеризация амониев цианат при нагряване.
Първо урея се синтезира от Е. Wohler през 1882 изомеризация амониев цианат при нагряване.
Реакциите, които се случват с промяна в състава на материята
Могат да бъдат разграничени Четири вида на тези реакции: съединение разлагане, заместването и обмен.
1. Реакциите на съединение - са тези реакции, в които две или повече вещества образуват един комплекс вещество.
В неорганични реакции химия всички съединения колектор може да помисли например реакции, които произвеждат сярна киселина от сяра:
1) получаване на серен оксид (IV):
$ S + O_2 = SO_2 $ - два прости вещества образуват един комплекс;
2) получаване на серен оксид (VI):
$ 2SO_2 + O_2↖2SO_3 $ - прости и комплексни съединения, образувани от един комплекс;
3) за производство на сярна киселина:
$ SO_3 + H_2O = H_2SO_4 $ - от двете съставни материали образува един комплекс.
Един пример на реакцията на съединение, при която едно комплексно съединение се получава от повече от два източник може да служи като краен етап за получаване на азотна киселина:
В органичната химия, реакционната съединение обикновено се нарича реакция на присъединяване. Всички разнообразие от такива реакции може да се счита за пример на блок от реакции, характеризиращи свойства на ненаситени съединения, такива като етилен:
1) хидрогениране реакция - добавяне на водород:
2) реакцията на хидратация - добавяне на вода:
3) реакция на полимеризация:
2. реакции на разлагане - тези реакции, в които комплекс вещество на образуваните няколко нови вещества.
В неорганична химия цялото разнообразие от такива реакции могат да се считат например, блокират производството на кислород реакции лабораторни методи:
1) разграждане на живачен оксид (II):
$ 2HgO↖2Hg + O_2 ↑ $ - един от съединение формира две проста;
2) разлагане на калиев нитрат:
$ 2KNO_3↖2KNO_2 + O_2 ↑ $ - един от съединение формира един прост и един комплекс;
3) разлагане на калиев перманганат:
$ 2KMnO_4↖K_2MnO_4 + MnO_2 + O_2 ↑ $ - един комплекс вещество образува две комплекс и прост, т.е. три нови вещества.
В органичната химия, реакцията на разлагане може да се счита например етилен блок получаване реакции в лабораторията и промишленост:
1) реакция на дехидратация (елиминиране на вода) етанол:
2) взаимодействие на дехидрогениране (водород абстракция) етан:
3) крекинг реакция (разцепване) пропан:
3. заместващите реакции - тези реакции, в резултат на което прости атома вещество заместени атоми на всеки елемент в сложна среда.
В неорганична химия, примери за такива процеси могат да служат реакции блокират характеризиращите свойства, например, метали:
1) взаимодействие на алкални и алкалоземни метали с вода:
2) взаимодействие на метал с киселина в разтвор:
3) взаимодействие с метални соли в разтвора:
Предмет на изучаване на органична химия не е проста работа, а само връзката. Следователно, като пример за реакции на заместване представя най-характерно свойство на ограничаване на съединения, по-специално метан, - способността на нейните водородни атоми заменени с халогенни атоми:
Друг пример - бромирането на ароматни съединения (бензен, толуен, анилин):
Забележка реакции функция заместването органични вещества в резултат на такива реакции произвеждат сложна и не е просто въпрос както в неорганична химия, и две комплекс вещество.
В органичната химия за заместване реакции включват някои реакция между две сложни материали, например, нитриране на бензол:
Той е официално обмен реакция. Това, че този заместителна реакция, става ясно само, когато се разглежда механизма.
4. обменни реакции - това реакция, при която две естери агенти обменят техните съставни части.
Тези реакции се характеризират с свойствата на електролити в разтвори тече през Бертоле правило, т.е. Само ако се образува утайка като вещество резултат газ или malodissotsiiruyuschee (например, $ $ N_2O).
В неорганична химия, може да бъде блок от реакции, характеризиращи, например, основи свойства:
1) неутрализиране на реакцията ще се образува сол и вода:
или в йонна форма:
2) реакцията между алкален и сол, която отива за образуване на газ:
или в йонна форма:
3) реакцията между алкалната сол и ходене за да се образува утайка:
или в йонна форма:
В Organic Reactions химия може да помисли блок характеризиращата, например, оцетна киселина свойства:
1) реакция, която продължава да се образува слаб електролит - $ H_2O $:
2) взаимодействие на газ ще се образува:
3) реакция ще образува утайка:
Класификация на химичните реакции да променят химически елементи окисление образуващи вещество
Реакциите, които се случват с елементи на промяна на окисление или редокси реакции.
Те включват различни реакции, включително всички реакции на заместване и тези реакции и разлагане на съединението, което включва най-малко един прост вещество, като например:
Както си спомняте, сложни реакциите на окислително-редукционни се приготвят по метода на електронен баланс:
В органичната химия поразително например редокс реакции на алдехиди могат да служат свойства:
Алдехиди 1 са възстановени до съответните алкохоли:
2. Алдехиди се окисляват до съответните киселини:
Реакциите ходене без да се променя степента на окисление на химичните елементи.
Те включват, например, да включват всички реакцията на йонен обмен, както и:
- Много реакция на свързване:
- Много от реакцията на разлагане:
Класификация на химичните реакции на термично въздействие
Чрез загряване на реакционната разделена на екзотермичната и ендотермични.
Тези реакции протичат с освобождаването на енергия.
Те включват почти всички реакцията на свързване. В редки изключение на ендотермични реакции на синтез на азотен оксид (II) от азот и кислород и взаимодействието на водороден газ с твърд йод:
$ N_2 + O_2 = 2NO - Q $,
Екзотермични реакции, които се появяват с освобождаване на светлина, по-долу реакции горене, например:
Хидрогенирането етилен - Пример екзотермична реакция:
Това е при стайна температура.
ендотермична реакция
Тези реакции се срещат с поглъщане на енергия.
Очевидно е, че те включват почти всички от реакцията на разлагане, като:
а) печене варовик:
б) крекинг бутан:
Брой изолира или абсорбира в резултат на енергия реакция се нарича топлината от реакцията. реакционно уравнение химически показва този ефект се нарича термохимична уравнение. например:
Класификация на химични реакции в сборната състоянието на реагентите (фазов състав)
Тази реакция, в който реагентите и реакционните продукти са в различни състояния агрегация (в различни фази):
Тази реакция, в който реагентите и реакционните продукти са в състояние на агрегиране (в една фаза):
Класификация на химичните реакции на участието на катализатор
Некаталитичен реакции протичат без участието на катализатор:
Каталитични реакции възникват с катализатора:
Тъй като всички биологични реакции, които се появяват в клетките на живи организми, са с участието на специални биологични катализатори на протеин природата - ензими, всички те принадлежат на катализатора или по-точно, ензимна.
Трябва да се отбележи, че повече от $ 70 $% химическите производства, използващи катализатори.
Класификация на химични реакции в посока на
Необратими реакции протичат при тези условия само посоката AP.
Те включват всички реакцията обмен, придружен от образуването на утайка, газ или malodissotsiiruyuschego вещество (вода), и всички реакцията на горене.
Обратими реакции при тези условия се появяват едновременно в две противоположни посоки.
Тези реакции са преобладаващото мнозинство.
В органичната химия, знак за обратимост отразява име-антоними процеси:
- gedrirovanie - дехидрогениране;
- Хидратация - дехидратация;
- полимеризация - деполимеризация.
Всички обратима реакция на естерификация (обратният процес, както е известно, се нарича хидролиза) и хидролиза на протеини, естери, въглехидрати, полинуклеотиди. Обръщане на основата на най-важният процес в живия организъм - обмяната на веществата.