Как да се определи броя на електроните в един атом, правя всичко сам
Един атом се състои от много плътен ядро заобиколено от електрон "облак". Ядрото грешка малко в сравнение с външните размери на облака и се състои от протони и неутрони. Atom в обичайния държавата е неутрален, а електроните носят отрицателен заряд. Но атом може също така да плъзнете електрони чужденци, или да дадете своя собствена. В този случай, ще бъде вече отрицателно зареден или положително зареден йон. Как да се определи колко много електрони, които се съдържат в атома?

инструкция
1. Преди всяко, ще се притекат на помощ на периодичната таблица. Гледайки го, вие ще видите, че всичко на химичния елемент има не само кърмата си определено място, но и лично сериен номер. Say водород, е единство, въглеродът - 6, за злато - 79 и така нататък.
2. Тази последователност от числа определя броя на протоните в ядрата, че е правилната заряд на атомното ядро. От това, че един атом в един обикновен състояние на неутрален, положителен заряд трябва да бъде базирана на отрицателен заряд. Следователно, водороден - един електрон въглерод - шест електрони. злато - седемдесет и девет електрони.
3. Но как да се определи броя на електроните в един атом. ако атом е, от своя страна, е част от някои по-големи молекули са трудно? Например, тъй като броят на електроните в натриеви и хлорни атоми, когато те образуват всяка молекула анулирате известен общ сол?
4. Няма нищо трудно. Започнете с факта, че пиша формулата на това вещество, че ще има още един поглед: NaCl. От формула ще се види, че молекулата се състои от сол на 2 елемента, а именно, алкален метален натрий халоген газ и хлор. Но това не е тясно неутрален натриев и хлорни атома, и техните йони. Хлоро, образува йонна връзка с натрий, по този начин "извади" от само себе си един от неговите електрони. и натрий, съответно, тя "даде".
5. Отново, погледнете в периодичната таблица. Вие ще видите, че натриевият има сериен номер 11, хлор - 17. Следователно, ние вече имаме натриев йон е 10 електрони. в йон хлорид - 18.
6. Действайки по същия алгоритъм, което позволява лесно да се определи броя на електроните във всички химичен елемент, независимо дали под формата на неутрален атом или йон.
Atom химичен елемент се състои от ядрено ядро и електрони. Съставът на ядрената ядрото включва два вида частици - протони и неутрони. Приблизително всеки атомна маса фокусирана в активната зона, тъй като протоните и неутроните са много по-тежки от електрони.

- атомен номер, изотопи
инструкция
1. За разлика от протоните, неутроните нямат електричен заряд, т.е. тяхната електрически заряд е нула. Следователно, знаейки, броят на основните елементи, не е възможно да се каже със сигурност колко неутрони, които се съдържат в ядрото му. Например в ядро въглеродни атоми неизменно съдържа 6 протони, протони въпреки че могат да бъдат 6 и 7. Вариации ядра химичен елемент с различен брой неутрони в ядрото се наричат изотопи на този елемент. Изотопи могат да бъдат естествени и неестествени получен.
2. Ядрена ядро определен азбучен символ на химичен елемент от периодичната таблица. В дясно на символа в горната и в долната част има две числа. Горният номер - е масовото число на атома, А = Z + N, където Z - ядрен заряд (брой протони), и N - chisloneytronov. Долната броя - е най-Z - отговаря за ядрото. Този запис съдържа информация за броя на неутроните в ядрата. Очевидно е, че е равен на N = A-Z.
3. различни изотопи на химичен елемент редица промени, което се отразява в записа на този изотоп. Някои изотопи са истинските им имена. Например, обикновено водород ядро не разполага с неутрони и протон. Водородни изотопи деутерий е един неутрони (А = 2) и тритий изотоп - две неутрони (А = 3).
4. Свързаност брой неутрони, записани от броя на протоните в N-Z диаграма ядрени ядра. Стабилността на ядра зависи от съотношението на броя на неутроните и броя на протоните. Сърцевини леки нуклиди особено стабилна, когато N / Z = 1, т.е., с равен брой неутрони и протони. С увеличаване на броя на масови смени област стабилност на стойностите на N / Z> 1, достигайки стойност на N / Z
1.5 за особено тежки ядра.
Atom се състои от ядро и околните електрони. които се въртят около ядрените електронни орбитите да образуват слоеве (енергийни нива). Броят на отрицателно заредени частици на външните и вътрешните нива определя свойствата на елементите. Chisloelektronov. съдържаща се в атома, е позволено да се открият, знаейки някои основни положения.
- - хартия;
- - дръжката;
- - периодична система на Менделеев.
инструкция
1. С цел да се определи броя на електроните. Използвайте периодичната система DI Менделеев. елементи таблицата са подредени в определена последователност, която е свързана с техните тесни ядрена структура. Знаейки, че положителния заряд на атома винаги равен на поредния номер на елемент, можете лесно да намерите броя на отрицателните частици. Чай vestimo - неутрален атом заедно, и по този начин броя на електроните е равен на броя на протоните, и броя на елемента в таблицата. Например, номер алуминиев последователност е 13. Следователно, броят на електрони ще бъде 13 в натриев - 11, на желязо - 26, и т.н.
2. Ако е необходимо да се намери броя на електроните в енергийните нива, повторете първото правило на Павел и Hund е правило. След това разпространете негативните частици от нива и поднива с помощта на една и съща периодичната система, или по-скоро своите периоди и групи. Тъй като броят на хоризонтален ред (период) показва броя на мощност слоеве и вертикалата (и) - броят на електрони във външния слой.
3. Не забравяйте, че броят на външните електрони е равен на броя на група само елементи, които са в главните подгрупи. В елементи на подгрупи от броя на отрицателно заредени частици в горния етаж на енергия не може да бъде огромен 2. Say скандий (Sc), разположен в периода 4 в група 3, на случаен подгрупата 2. Докато галий (Ga), този, който е в същия период и съща група, но в основната подгрупата , 3 външни електрони.
4. Когато преброяване на електроните в един атом, имайте предвид, че последната форма на молекулата. Атомите могат да се предприемат, за да се получи отрицателно заредени частици за образуване на универсален двойка. Например, в молекулата на водород (Н2) универсален двойка електрони. Друг случай: в молекулата, натриев флуорид (NaF) общо количество на електрони ще бъде равен на 20. Въпреки това, по време на химическата реакция на натриев атом дава своята електрон, и е 10, и получава флуоро - 10 навивки, също.
здравословни съвети
Не забравяйте, че във външния слой на енергия може да бъде само на 8 електрони. И това не зависи от местоположението на елемента в периодичната таблица.
Atom - е най-малкият стабилен (в повечето случаи) частица на материята. Молекула наричан също няколко атоми, свързани заедно. Това молекула се съхранява в себе си информация за всички свойства на дадено вещество.
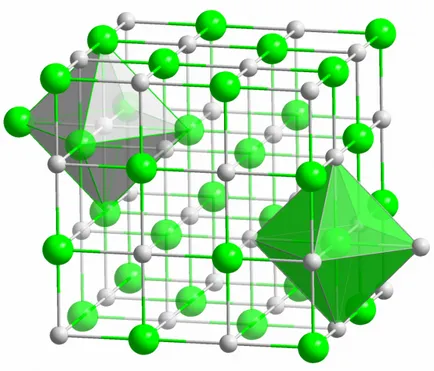
Атоми образуват молекулата с помощта на различни видове комуникация. Те се различават по посока и енергия, с помощта на което позволи на тези отношения да се образува.
квантово-механичен модел на ковалентна връзка, на
Връзката на ковалентна се образува чрез валентните електрони. При приближаване 2 атома наблюдавани припокриващи електронни облаци. Електроните на всички атоми започнат да се движат в областта, принадлежащи към друг атом. В пространството около тях, не е прекомерно отрицателен потенциал, който издърпва положително заредените ядра. Това е валидно само при условие, че електроните са антипаралелен обща завъртания (насочени в различни посоки) .Kovalentnaya връзка има доста голяма енергийна стойност трябва да отлети атом (около 5 ЕГ). Това означава, че необходимостта от 10 ЕГ, така че молекулата на 2 атома образуват ковалентна връзка проби. Атомите могат да дойдат близо един до друг на приблизително определено състояние. С тази конвергенция проследяват припокриване на електронните облаци. Теза Паули казва, че по същото атом не може да се върти двата електрона по идентичен състояние. Huger проследяват припокриват, толкова повече атоми отблъскват взаимно.
водородна връзка
Това е специален случай на ковалентна връзка. Тя се формира от два водородни атома. Това е пример за химичен елемент в двадесетте години на миналия век, беше показано, че механизмът на образуване на ковалентна връзка. водород dyuzhe примитивен в своята структура, която разрешава на учените да се реши по отношение на истинската уравнението на Шрьодингер.
йонна връзка
Кристал всеки vestimo сол, образувана с помощта на йонна връзка. Това се случва, когато атомите, които образуват молекулата, притежават голяма разлика в Електроотрицателност. По-малко електроотрицателна атом (в случая на кристала на сол е натриев) изпраща цялата си валентните електрони хлор, преминавайки правилно зареден йон. Хлорът, от своя страна, става отрицателно зареден йон. Тези йони са свързани в структурата на електростатично взаимодействие, което се характеризира с твърде обширна сила. Ето защо йонна връзка има най-висока концентрация (10 ЕГ на атом, който е два пъти Huger от енергията на ковалентна връзка). В йонни кристали недостатъци на различни видове dyuzhe рядко наблюдавани. Електростатично взаимодействие твърдо държи положителни и отрицателни йони в определени места, се появяват предотвратяване места, ofinterno- Dal и други недостатъци на кристалната решетка.
здравословни съвети
Протоните - тя одобрително заредени частици, неутрони не носят никаква такса.
виж също
- Как да се изчисли възрастта на котката

- Как да плета палто за момичета

- Как да се определи възрастта на костенурката

- Как да се готви вентрикули
