Фаза на равновесие в еднокомпонентна система
Фаза на равновесие еднокомпонентни системи
След изпаряване, топене, сублимация (сублимиране) примери на промени в състоянието на материята, не е придружено от промяна на химическия състав.
Фаза вещества е състояние на еднакво значение по химичен състав и физични свойства. Има твърди, течни, газообразни фаза. Твърдите фази за едно и също вещество могат да се различават, например, фосфорен алотропна модификация (бял и черен фосфор).
Фаза преход това спонтанно превръщане на една фаза към друга, което се случва при определено налягане за дадена температура.
температура фазов преход


Диаграмата фаза - графично изображение в "налягане температура" координати, графично показване на температурата и налягането, при които различни термодинамично стабилна фаза на веществото.
граници фаза са линии, които разделят тези области. Всяка точка на тези линии (граници фаза) принадлежи едновременно както на региона фаза, т.е. тя съдържа равновесие двуфазна. Този баланс се наблюдава в съответното налягане и температура.
Обърнете внимание на детайлите, които показват, фазовите граници.
Фазата граница разделяне на твърдо вещество регион и региона на течно състояние на материята, показва зависимостта на температурата на топене на налягането.
Топене температура Температурата се нарича Т, който в даден налягане съответства на състояние на равновесие между течни и твърди фази на материята. Веществото се топи при същата температура, което се втвърдява и следователно температурата на топене е температурата на кристализация (замразяване). Ако налягането е 1 атмосфера и след това се получи нормална температура на топене (замразяване).
На фазовата граница между област на стабилна наличие на течност и е с площ на стабилна наличие на течност газ и газ са в равновесие. Но чист газова фаза на вещество, което е в равновесие с това вещество в течно състояние (или твърдо състояние) се нарича наситена пара вещество. Налягането на парите в равновесие с течността, наречен пара вещество налягане. Следователно фаза граница zhidkostpar фазова диаграма показва как парното налягане на течния вещество в зависимост от температурата.
По същия начин, в твърда фаза равновесие линия двойки показва ефекта на температурата върху наситен стойност на налягането на парите чрез сублимация.
При нагряване на течност в отворен съд, ще му изпаряване от повърхността. Когато температурата се достига при които налягането на парите равно на външното налягане, процесът на изпарение ще покрие целия обем на течност и пари започва да се разпространява в околната среда. Метод свободно изпаряване на течен обем наречен изпаряване.
Температурата, при която наситен парното налягане течност стане равна на външното налягане, точката на кипене се нарича при дадено налягане. Ако външното налягане е 1 атмосфера, точката на кипене се нарича нормална температура на кипене.
Когато набор от термодинамични променливи в три равновесни фази може да бъде едновременно: течност + твърд + пара или течност + твърдо вещество (модификация 1) + твърдо вещество (модификация 2). На диаграмата фаза на този феномен съответства на тройната точка. които пресичат границата на трифазен. Както ще бъде показано по-късно, позицията на тройната точка на въздействие не може да се реализира, когато е единична, добре определена температура и налягане характерно за веществото.
Ако течността се загрява в затворен съд, той ще бъде други мероприятия. Тъй като температурата на парното налягане ще се увеличи и следователно, ще растат и масова плътност. В същото време на маса плътността на течността ще намалява поради разширение. В един момент маса плътност на течност и пари стане идентични, и границата между двете фази изчезва. Температурата, при която се появява това явление се нарича критичната температура на веществото и парното налягане, съответстващо на критичната температура, критичното налягане . При температури над критичната точка не е отделен течна фаза и парна фаза (или фаза граница съществува zhidkostpar). В затворен съд при температура над критичната фаза има уникален вещество, наречено суперкритичен флуид. Той заема целия обем на затворения контейнер.
Прието газова фаза над критичната температура в отворен съд, наречен газ и пара, разположен под критичната температура. Тя може също да се отбележи, че над критичната температура на газа при всички налягания не може да се прехвърля в течната фаза.
Условия за фазово равновесие.


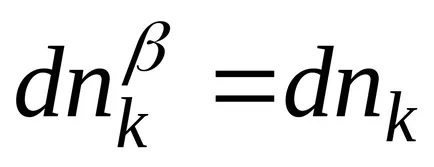

Координати PKR критична точка за вода. = 218 атм и TCR. = 374 ° С
ОА и OC криви представляват зависимостта на налягането на наситените пари над течна вода, и следователно над температурата на лед, и линия OB зависимост точка на вода (или лед топене) на налягане замразяване. Вода характеристика наклон на линията OB наляво, което съответства на намаляване на температурата на топене на лед с нарастващ натиск. Кривата е продължение на OD ОС крива и определя парното налягане на преохлажда течна вода. OD на парцел и водната пара са в метастабилната състояние (в състоянието, съответстващо на нестабилно равновесие). метастабилни държавни агенти имат голям марж на Гибс енергия, отколкото в стабилно състояние и химичния им потенциал е по-голям, отколкото химичния потенциал в стабилно състояние. Следователно, ще настъпи спонтанно преход на вещество от метастабилни състояние в конюшнята. На всяка от граничните линии на промяната на системата е равен на единица. Това означава, че един от параметрите (или налягане или температура) може да варира произволно, друг вариант няма да остане постоянна, но ще варира в съответствие с първата. Тогава броят на фазите в равновесие, ще останат същите, т.е. равна на два по линиите на фаза равновесие.
Координатите на тройната точка в pt.t. с ниско налягане = 4.6 mm Hg и tt.t. = 0,0098 до С (точка Г на Фигура 3). На този етап системата bezvariantna, броят им е три фази в равновесие. Най-малката промяна всеки от параметрите, води до изчезване на един или два етапа. Например, увеличаване на температурата при постоянна advlenii или намаляване на налягането при постоянна система temperautre в газообразно състояние. Увеличаването на налягането при постоянна температура на системата в течно състояние на вода и намаляване на температурата при постоянно налягане в условия лед.
Фиг. се вижда, че има модификации на лед, ледът 9. Трябва да се отбележи, че различните модификации на отваряне лед, съществуващи към по-високи налягания, а не само от интерес за учените, но също така влияе на музикантите и писатели. Известен албум Семантичната Халюцинации, наречена Ice 9. книга от американския писател Кърт Вонегът "Котешка люлка на" един от ръководителите на т.нар Lod9. В тази работа, разказвачът на име Джон работи върху книга за атомната бомба пусната над Хирошима. Оказва се, че един от създателите на бомбата, Феликс Honniker, изобретен вещество, което може да се превърне в лед всичката вода на Земята Lod9. Този фантастичен Lod9 има температура на топене около 114,4 F, или въз основа на скалата на Целзий

Ако отидете от литературния отново примера на фаза схема на лед, можете да видите, че и тук има няколко фазови граници и точките, в които трите фази са в равновесие. Някои тройни точки характеризират равновесие на две модификации на лед и вода в течно състояние, някои три модификации лед.
Интересното е, че при налягане от около 40,000 атм лед VII е в равновесие с вода в течно състояние при температура от около 200 ° С, например Горещо е.
фазовите граници в държавните диаграми
уравнение KlauziusaKlapeyrona
Помислете обикновено сключен равновесие уравнение на двете фази. и

,
където






Сега приравняваме диференциалите на химичните потенциали:
Ние означават фазовата разлика между моларните ентропии
и наричаме това количество моларен промяна ентропията в прехода от фаза


По същия начин, за моларен обем
Заместващите уравнения (22) и (23) в (21) и допълнителни резултати преобразуване във форма на уравнение KlauziusaKlapeyrona
От друга страна е известно, че при постоянна температура и налягане (по-точно, това е състояние на равновесие на двете фази, т.е. тя съответства на всяка точка на равновесие линия
Използване на връзката (25) може да получи друга форма на уравнение KlauziusaKlapeyrona
KlauziusaKlapeyrona уравнения дават възможност да се установи, опита да се изчисли зависимости

Фаза граница твърдо veschestvozhidkost
Фазов преход на фаза граница твърдо вещество течност е или процеса на топене (фаза след това краен faza течна фаза и tverdoe това първоначално състояние фаза) или процес на кристализация (време на фаза краен твърдо състояние faza и фаза е първоначалната течна фаза). Фигура 3, фаза диаграма на вода, тази фаза граница е определена ОВ. фазови преходи и веригата има формата:
.
Следващите отношения
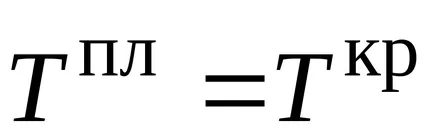




и уравнение KlauziusaKlapeyrona, например, за процеса на топене могат да бъдат написани както следва
където

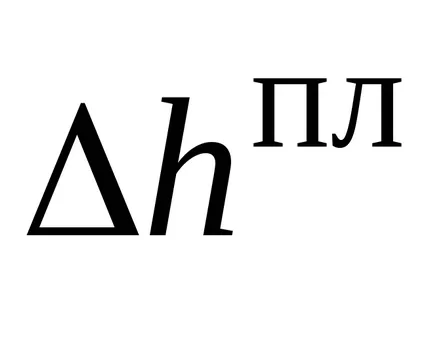

Анализ на уравнение (27). Количеството в ляво - това е в интерес на истината - наклона на граничната линия в davlenietemperatura на координати. моларна Промяната на енталпията на топене почти винаги положителни (с изключение на лед и няколко други вещества). моларна промените силата на звука по време на топене най-често е положителна, но тя е малка. Следователно можем да кажем, че наклона на равновесие линия между твърди и течни винаги е висока, обикновено позитивни и постоянни доста голям набор от натиск. Топенето крива е почти права линия.
Уравнение (27) могат да бъдат интегрирани, приемайки, че в този температурен интервал аудио моларен слят енталпия, аудио промяна моларен обем на топене не зависи от температура и налягане. След това изрично се ограничат линия уравнение в координатите temperaturadavlenie ще изглежда така:
където

Фаза граница течност - пари
Фазовият преход в течност - газ може да бъде или изпаряване или кондензация. Фигура 3, тази фаза граница, посочена от операционната система. един процес, който се извършва в тази фаза граница може да се представи схема:
.
KlauziusaKlapeyrona уравнение за изпарение може да се запише като:
където Т фаза температура преход, т.е. точка на кипене;


Както линия ще се намира, което е характерно за изпаряване по отношение на предишния ред на синтез?

Ако размерът на моларното количество на течната повишаване на налягането ефект не е много важно, тогава стойността на моларното количество на пара съгласно уравнението MendeleevaKlapeyrona, намалява с увеличаване на налягането. Като цяло, намалява, и промяната в моларен обем чрез изпаряване, и по този начин се увеличава стойността
