етилен химикали и неговите производни в промишлен органичния синтез, резюме
Етилен оксид и синтез на базата на това ...........................................................................
Синтези Етилен хомолози ........................................................................ ..
Библиография ............ .. .......................................................
Етилен първо се получава от германския химик Йохан Вехер в 1680 под действието на масло Витролово в духа на вино. Първоначално той е бил идентифициран с "запалими въздуха", т.е. с водород. По-късно, през 1795 godu етилен подобно получени холандски химици Deyman, Potts ван Trustvik връзка и Lauerenburg и описани под наименованието "maslorodnogo газ", както е установено етилен способност за свързване хлоро до образуване на маслена течност - етилен дихлорид ( "масло холандски химици ").
Изследването на свойствата на етилен и неговите производни и хомолози започна с средата на деветнадесети век. Началото на практическото използване на тези съединения сложи класическите изследвания AM Butlerov и неговите ученици в областта на ненаситени съединения и специално създадена Butlerov теория на химична структура. През 1860 г. получава етилен действие на меден йодид, метилен, определяне на структурна формула етилен.
Етилен е безцветен газ със слаба, едва забележим миризма. Това е слабо разтворим във вода (при 0 ° С в 100 г вода се разтваря 25,6 мл етилен), светлинен пламък изгаря, образува експлозивни смеси с въздуха. На термично по-малко стабилен от метан. Още при температури над 350 ° С, етилен частично се разлага на метан и ацетилен:
При температура от около 1200 ° С, за да дисоциира главно ацетилен и водород;
В природен газ (с изключение вулканична) етилен не е намерен. Тя се формира от пирогенен разлагане на много природни съединения, съдържащи органични вещества.
Процесът на пиролиза за получаване на етилен се провежда в пещи на различни устройства чрез преминаване газообразни въглеводороди или техните пари в присъствието на катализатор при температура 760-780 ° С Често използвани тип тръбна пещ. Етилен могат да бъдат получени чрез дехидрогениране на етан:
и внимателно хидрогениране на ацетилен:
За етилен и неговите хомолози пиролиза изходна суровина се използва етан, пропан, бутан, съдържащи се в газовете, освободени от нефт, газ и топлинна каталитичен крекинг, както и течни въглеводороди: nizkoaktanovye природен бензин и бензин директно масло фракция legroinovye раса.
Ефективността на съществуващите пещи за пиролиза на въглеводороди е 3,5-4 тона суровина за час. ново строителство пещ, предназначена да обработва 7-10t суровина за час.
При определени условия на пиролизен бензин при получаването на етилен милиардт могат да бъдат едновременно разпределени: пропилей - 0,65t; изобутилен - 0,11t; п-бутилен - 0,11t, дивинил - 0,12t; бензол - и толуен 0165 т - 0,08t, използването на което значително ще подобри технически и икономически показатели на нефтохимически инсталации. Получава се от етилен от над 200 съединения, най-важните от които са етил хлорид, 1,2-дихлороетан, хлороетанол етилен оксид, диоксан, етилен гликол, етилен гликол етилов етер, uksusnoglikolevy етер, диетилен гликол, етиламин, етаноламин, диетаноламин, триетаноламин.
Халогенирането на етилен.
Конвенционалната реакция между ненаситени въглеводороди и халогени е добавянето на халогенни атоми на мястото на двойната връзка да образуват с четен брой халогенни атоми халоген. Въпреки това, олефини с разклонени вериги, и при висока температура и при нормална структура олефини халогениране протича по-трудно да се образуват и ненаситени monogalogenoproizvodnyh polychlorides.
Активност халоген присъединителни реакции намалява с увеличаване на молекулното тегло. Флуор реагира енергично допълнение хлор реакция протича много по-бавно.
На първо място, хлориране на етилен получава дихлороетан:
Въпреки това, хлориране на етилен може да отиде по-далеч, в резултат на трихлоретан и тетрахлороетан. От тези продукти се увеличава с увеличаване на температурата на реакцията. За инхибиране реакция заместване верига при хлориране на етилен и по-чист процес дихлороетан се провежда при ниски температури и в присъствието на малки количества от железен хлорид и O2.
Трябва да се отбележи, че EV Alekseevskii през 1928 г., се установи, че чрез прекарване на смес от етилен и хлор върху въглен при 120 ° С чист дихлоретан се получава с добив 80% от теоретичния.
Метод за получаване на дихлоретан чрез хлориране на етилен в индустрията се провежда в реактор с разбъркване резервоар или балон тип кула. Основно се изсушава предварително, за да се избегне корозия на оборудването, хлор и етилен с последния малък излишък (5-10%) се подава отделно към долната част и reaktora1 пропуска през слой от дихлоретан.
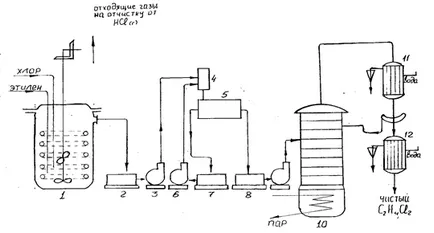
Излишъкът канализацията в дихлороетан събиране 2. газове, съдържащи дихлороетан двойка, хлороводород, нереагирал етилен се доставят vymorazhivatel за извличане дихлороетан, и останалите газове се промиват с вода за отстраняване на хлорид, и след това се извежда от системата. От събирането на суров 2-дихлороетан помпа 3 е насочено към смесителя 4, където разтваря хлороводород се неутрализира 5-10% натриев хидроксид. След азеотроп дихлороетан вода се отдестилира при 72 ° С в азеотропна колона сушене, не е показано на фигурата, и за изключване на трихлороетан и други примеси, доставени на дестилационната колона 10.
Процесът се провежда в течна дихлоретан, който се разтваря хлор и етилен и осигурява желаното отвеждане на топлината от реакционната зона. Дихлоретан циркулация през външен топлообменник позволява взаимодействие с добър добив при температура от 30-40 ° С
Дихлоретан е получил широко практическо приложение като незапалим разтворител при екстракция на мазнини и синтез на такива ценни химикали като етилен гликол и неговите естери, етилендиамин, дибензил, винил хлорид, полисулфид синтетичен каучук (Тиокол) и други. Дихлоретан се използва за борба с вредители / х (опушване или опушване).
Това дихлороетан лесно разцепва хлороводород, се превръща в винилхлорид:
Производството на този мономер е важно за индустрията и се изпълнява от други методи. Когато се образува хлориране на етилен при температура от 430 ° С винил хлорид:
Сериозен недостатък на метода за производство на етилен дихлорид решения е трудността за разделяне на солите от процеса и отдестилиране етиленгликол uparki вакуум на.
Най-удобният начин за получаване на хидратиране на етилен е етилен оксид. Тя обикновено се провежда в присъствието на малки количества (0.05%) сярна киселина като катализатор. Сместа се нагрява в автоклав при 100 ° С в продължение на два часа. Получава се много чист етилен гликол като 25% разтвор.
Етилен гликол има много приложения. Той се използва при подготовката на антифриз се използва за охлаждане на двигателите на автомобилите, самолетите, вместо саламура чилъри и т.н. антифриз се използват за защита на елементите от обледеняване (витлов самолет от). Гликол е обща пластификатор за различни лепила. Заедно с глицерин тя се използва като успокояващо средство в печатната индустрия.
Тъй като етилен гликол се получава, много вещества, които имат голямо практическо значение, например dinitroetilenglikol, естери с органични киселини, полигликоли и т.н.
Етилен оксид реагира енергично с амоняк, като различни етаноламини, които са намерили практическо приложение.
1. Моноетаноламин Н2 N-CH2 -СН2ОН - дебелина, сироп, силно хигроскопичен течност като силно изразена основни свойства.
2. Диетаноламин NH- (СН2 -СН2 ОН) 2 - и димяща лесно разтворими във влажни въздушни кристали с точка на топене 28 ° С
3. триетаноламин N- (СН2 -СН2 ОН) 3 - силно вискозна течност, бързо потъмняване на въздух. Той абсорбира влагата и въглероден диоксид.
Триетаноламин, диетаноламин, и отчасти се използва за
извличане на въглероден диоксид и водороден сулфид от промишлени газове, като например почистване на нефт или природен газ. Те са също така широко използвани като основа за производството на сапун.
Синтез Етилен хомолози
Среда хомолози на етилен - пропилей и бутилен - повече химически активни от етилена. Техните реакции са разнообразни и се появяват по-лесно, и въглеводороди като начало се използва все повече в промишлен органичния синтез.
Alkirirovanie бензен с пропилей ще изопропилбензол (кумен), който се получава чрез окисление на фенол и ацетон. Когато пропилей хидратация образува изопропилов алкохол. Процесът се провежда в непрекъснат колони при температура от 40-50 ° С, използвайки 80-85% сярна киселина или в присъствието на течни или твърди катализатори (например намалена волфрамов оксид върху силикагел) - прав
Изопропилов алкохол се използва за получаване ацетон, оцетен анхидрид, диизопропилов етер, водороден пероксид, в парфюмерийната промишленост, а също и като разтворител.
Хлориране, последвано от третиране с пропилей hloroproizvodnyh сега е една от промишлените методи за получаване на глицерол. При високи температури (360-400 ° С) в присъствието на някои катализатор (активен въглен) се заместват с водородни атоми в метиловата група на пропилей и хлор на алилхлорид се получава:
Промишлеността също извършва производство на акролеин от глицерол допълнение към него на водороден пероксид, последвано от редукция на глицералдехид.
Основната посока при използване на н-бутен е неговата дехидрогениране да произвежда бутадиен - 1.3 (дивинил), алкилиране, хидратация и изомеризация на бутил алкохол изобутилен.
Производство на бутадиен от н-бутан и н-бутени може да се извърши на два етапа или в един етап. Дехидрогениране на п-бутан - ендотермичен процес:
Чрез процес на два етапа за получаване на изходните материали - бутан фракция се подлага преди да дестилация, и се подава към първия етап на процеса - дехидриране на н-бутан до бутен, който се провежда при т ° = 530-600 ° С при катализатор alyumohromovom активиран с калиев хидроксид и метални оксиди. За тази цел тръбни реактори се използват с фиксирани и движещи реактори легло, както и апарат с кипящ слой с прахообразни катализатор. След охлаждане, компресия и пречистване на получените продукти отделя фракция, съдържаща бутилен, която е насочена към втория етап - в адиабатен реактора, в които има решетка с катализаторния слой. В този случай, отидете на следните реакции
За да се изолира чист дивинил прилага физични и химични методи, които могат да бъдат споменати екстракционна дестилация и абсорбция на воден амонячен разтвор на меден ацетат (хемисорбция). Нереагиралите бутилен върнати на дехидриране.
За бутаноли на бутан-бутилен част, разделени от крекинг газ - процес са сярна киселина. Прилагане на разтвори на хлороводородна киселина с различни концентрации (55-80%) се възстановява от смес, съдържаща бутани и трите изомерна бутилен: първо изобутилен като по-активния изомер, и след това останалите бутилени като съответните вторични и третични алкохоли. Почистване алкохол, произведен чрез дестилация.
Изомеризацията на изобутилен чрез преминаване п-бутен чрез устройството за доставяне на тон ° = 300 ° С в присъствието на катализатор на фосфорна киселина, отпечатан върху шамот. Изобутилен има висока активност и се прилага успешно в индустрията за синтез на изооктан, полиизобутилени, за butilkauchika някои ароматни вещества (изкуствен мускус) и в няколко други индустрии.
По-сериозен източник за производство на изобутилен се бутилен крекинг газьол и пиролиза. Директно от изобутилен тези газове могат да бъдат възстановени чрез дестилация
½ ½ ½ ½
Алкилиране с олефини се използва в промишлеността в много голям мащаб. Така се получава етилбензен и, на базата на стирен, алкил феноли и детергенти. Като катализатори се използват минерални киселини, метални хлориди, сулфонова флуорид, бор и други. Например, чрез взаимодействие на фенол и изобутилен в присъствие на сярна киселина се получава третичен бутилфенол, се използва като междинно съединение при производството на фенолформалдехидни смоли, които са разтворими в масла, както и за производството на бактерициди инхибитори, korezina (успокояващо синтетичен каучук).
Полимеризацията на олефини.
Полимеризацията реакция на съединение, наречено заедно голям брой молекули на същото вещество (мономер) до голяма молекула (полимер). Тази връзка се дължи на освобождаване на валенции на прекъсване двойни връзки.
Химичен състав на образуваната високо молекулно съединение е същият като този на изходния мономер.
Етилен polirizuetsya с голяма трудност от реакцията:
Списък на използвани литература.
1. Valakin VP "Получаване на синтетичен етилов алкохол"
София, Издателство "Химия" 1976.
2. "Кратка Химическа енциклопедия", Т5,
издателство "Съветски енциклопедия", 1967.
3. "Обща Organic Chemistry", изд. NK Kochetkov, Т1
София, Издателство "Химия" 1981.
4. AV Степанов "Производство Етилен"
Киев, издателство "Naukova Dumka", 1973
5. Ugriumov PG Авербук АЙ "Органичен синтез в индустрията"
София, издателство "Просвещение", 1964.