Анодна процеси - studopediya
Като цяло, процесът на анодна е писано:
В зависимост от състоянието на агрегация на процесите анодните получените продукти са разделени в редокс процеси без изолиране на независим фаза, процесите за да образуват твърди процеси отделянето на газ анод продукти, процеси с разтваряне анод материал (разтворими аноди).
По метода без изолиране на процесите самостоятелно фаза включва продукцията на силни окислители.
Хлориране концентрира алкални разтвори с реакциите на образуване на хипохлорит и хипохлориста киселина:
Cl2 + OH - = NS1O + Cl - (3.44)
Допълнителна хипохлорид се окислява при анода към хлорат:
Друг пример на - образуването на persulfuric киселина чрез електрохимична оксидация на концентрирани разтвори на сярна киселина:
последвано от димеризация на радикалите
По същия начин, анодът е готов перманганат йон:
Точно както в случай на възникване на такива процеси на катода, поляризацията на анода се определя от вида и концентрацията трудности в доставка на анода на редуцираната форма на веществото и прибиране от повърхността на окислената форма на анод материал. Разпределението на дейности в обвивката, показана на ris.3.9, крива поляризация за катодна и анодните процеси е показано на ris.3.10.
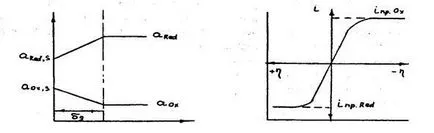
дейности Ris.3.9.Raspredelenie Ris.3.10. Въведете поляризиращ слой в кривата на анод
По този начин стойността на поляризация е свързано с размера на плътността на тока от уравнението:
Пример за процеси на анода да образуват твърди продукти се електролитно получаване МпО 2.
Процесът намалява окисляването на анода на двувалентни манганови йони и тривалентни за състоянието на четиривалентен:
Освен това, Mn 4+ йони се получават чрез диспропорциониране на Mn 2+ йони:
2 милиона 3+ = Mn2 + + Mn 4+. (3.52)
След образуването на МпО 2 се дължи на реакции на хидролиза:
Той играе важна роля в тази фаза на процеса на поляризация.
При високи плътности на тока, ниски температури и концентрации на Mn 2+ поляризация фаза се увеличава, което води до фин манганов диоксид. При ниски анодните плътности на тока, по-високи концентрации на Mn2 + и температури поляризация фаза се намалява, което позволява да се получи груба манганов диоксид.
По същия начин те са изготвени PbO2. SnO2, и други продукти.
Широко разпространени хидрометалургични процеси с еволюция анодна газ, такива процеси за производство на хлор чрез електролиза на водни разтвори на натриев хлорид, процеси за производство на кислород в електролитната разлагане на вода. Поляризация в този случай обикновено е фазата и определя или от трудности, свързани с рекомбинация на адсорбираните атома в молекулата, или образуването и разпадането на повърхността на анода комплексни съединения. Това е илюстрирано на извивките на поляризацията на анод материал (Фигура 3.11 и 3.12). Освобождаването на кислород се случва съгласно реакциите:
в разтвори на соли и основи
в разтвори на силни киселини:
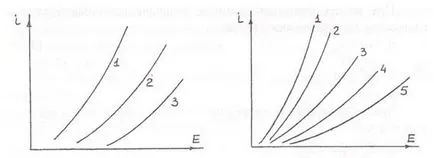
Ris.3.11.Polyarizatsiya анод на анода при Ris.3.12Polyarizatsiya
разпределение хлор на натриев хлорид от кислород еволюция 0.1 N КОН
(250 гр / л) при 80 ° S.Material анод: при 17 ° С Анодни материали:
1-Pt; 2-графит; 3-1 магнетит-Cu; 2-Ni; 3-Ag; 4-графит; 5-Pt
Най-високата отделяне на кислород високо напрежение, стойности типичен за метали от платиновата група, които проявяват ниски стойности на пренапрежение освобождаване водород. Пренапрежение зависимост от плътността на тока е Tafel характер:
Н = а + blgi. (3.57)
коефициенти А и В се различават с плътността на тока, поради различното естество на междинни фази се образуват. По този начин, платинов анод да се увеличи плътността на тока появят последователно образуване и гниене на повърхността на по-високите оксиди RtO2 нестабилна. RtO3. RtO4. стъпка определя, че характер з-ИМС преки и много високи стойности на кислород еволюция пренапрежение достигат при 1 А / ст2 1.38 V.
За всички, на електродите с отделяне на газ се характеризира с така наречената "анод ефект". Това се проявява в рязкото увеличение на устойчивост на граничната повърхност между анод-електролит, което води до увеличаване на електролиза напрежение 10-100 V, поява на искра освобождаване в анодният слой.
Причини за възникване на анодни ефекти са двусмислени. Те могат да бъдат слабо провеждане повърхност тип CFN съединение. SCln. ХБРЯ т.н.
Друга причина може да бъде не-газ-хидродинамично съпротивление, което възниква, когато с увеличаване на анодна плътност на тока за критичните газообразни продукти не е нужно време, за да се оттегли от плик анод анод зона. Полученият филм има същото газ в сравнение с електролита значително голяма устойчивост и причинява анод ефект. Последното тълкуване се подкрепя от зависимостта на плътността на критичния ток на овлажняваща способност анод електролит. Колкото по-добре Мокрещата, по-високата IC.
Анодно разтваряне на метал съгласно реакцията
Me - Me NE = N + (3.58)
придружен от или електрохимична или концентрация поляризация. Предимно, като правило, един и същи вид на поляризация, който е широко разпространен за процеса на катод.
В електрохимична стойност контрол поляризация, свързан с плътност на тока Tafel уравнение
Когато контрол дифузия - концентрация уравнение поляризация:
Концентрацията на разтворените метални йони в обвивката (CS) се увеличава в пряка зависимост с увеличаване на плътността на тока в съответствие с уравнението
При достигане на границата на разтворимост на металната сол в електролита в анод повърхност филм образуван твърди соли затруднява изхвърлят продуктите от електролизата на обема на електролит, рязко увеличава спад на резистентност и напрежение в електролита, което намалява ток електролиза. Това явление се нарича "сол пасивиране".
Чрез преместване на аноден потенциал за положителни стойности за броя на метали Passivating условия са създадени, за да се образува на повърхността на тънки (2-10 микрона), но достатъчно плътни оксид филми на пасивиращ анода, предотвратяване на преминаването на електролиза ток и да доведе до значително поляризация на анода. Това явление е известно като "пасивиране оксид" или просто "пасивиране на анод."
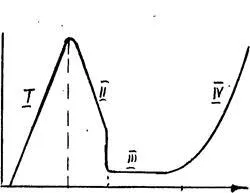
Пример за това е анодно разтваряне на желязото в H 2SO 4 разтвори (3.13)
Ris.3.13.Vid криви поляризация за пасивиращ метал (Fe в разтвори на сярна киселина) аб - площ на активното разтварянето на желязо до образуване Fe2 +. Еф - flyade потенциал - електрод потенциал преход към пасивно състояние, съответства на реакцията 2Fe + 3H2 О = 6e-Fe2 + О3 6Н +; бг - област на пасивно състояние (DE); ГД - селекция от O2 анод.
Един пример на смесен "сол" и "оксид" пасивация е анодно разтваряне на олово в разтвори на сярна киселина (фигура 3.14).
1- разтваряне на активната област:
В Е = 0.356 В OL RbSO4 постигната. възниква сол пасивация (област II).
= 0,615V Когато анод възел се постига в пасивно състояние:
0 0,356 615 1,23 E
Фигура 3.14. Тип поляризационни криви за сол и Passivating оксид (Pb в разтвори на сярна киселина)
Когато 1229 в кислородни еволюция потенциали постигнати чрез взаимодействие на Н 2О - 2е = 2Н + + 1 / 2O2 (площ 1U).
Защото пасивация поради появата, придавайки номер на продукта на свойствата на металната повърхност гъста оксид филм, продукти на процеса анодиране широко използвани в промишлената практика (антикорозионен термоустойчиво покритие, грунд за боядисване, декоративни покрития и др.)
Въпреки това, при разтваряне и рафиниране на метали, това явление е силно нежелана, тъй като води до драстично намаляване на скоростта на разтваряне, значително поляризация на анода, на йонизация електроположителни примеси, замърсяване на метал на катода. За да се намали отрицателното въздействие на пасивиране на анода използва редица техники:
1) използване на обратен ток за превод и поддържане на анода в потенциала на активното разтваряне (VG Лобанов)
2) superpassivation анод, което води до образуването на високи оксиди са лесно разтворими в електролита. Например, при високи пренапрежения пасивиращ оксид CR2 О3 става разтворим дихромат, CR2 О7 2-,
3) въвеждане в електролитни активатори: СГ -. Br - I -. И F - и т.н.
Активатори адсорбция изместват от повърхността на електрод Passivating агенти, като по този начин предотвратяване на пасивиране на анода.
Например, хром в разтвори на сярна киселина е в пасивно състояние и не взаимодействат с него. Необходимо е да се въведе разтвор на NaCl като бързо взаимодействие започва хром и сярна киселина с отделяне на водород.
Анодно разтваряне на сплав (амалгама) допълнително се усложнява от сплав концентрация поляризация:
hspl = - LN. който може да бъде изчислена от граничната стойност на тока йонизация на разтвореното вещество метал амалгама на:
Тип поляризационни криви, показани на фигура 3.15 на амалгама с различни концентрации на електроактивни метал (х1> x2> 3 пъти).
Фигура 3.15. Вид на поляризационни криви за прекратяване на амалгами
По принцип, всички метали рафинерия трябва да се разглежда като сложни сплави. Първоначално електроотрицателни компоненти се извличат от тях. Например, за мед (Е ° = 0,337V) е Pb (Е о Pb 2+ / Pb = -0,126B), Ni (-0,24 V).
Тъй като концентрацията на тези метали е ниска, тяхното разтваряне е в сегашната граница с основния процес - йонизация на мед.
Както повърхностния слой мед разтваряне обогатен съдържание на електроположителни елементи на злато и сребро: Ag (Е ° Ag + / Ag = 0,799V), Au (Е ° Au + / Au = 1.7V). Когато не може да се постигне технологията на йонизация потенциала на тези метали и разпада на анода чрез преминаване на суспензията.
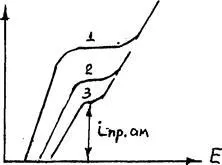
Въпреки това, когато значителна анод поляризация (поради пасивиране или INP постигне разтваряне на медна сплав) поради големия съдържанието на Ag, Au може да възникне йонизация на благородни метали, които увеличават загубата на мед от катода (фигура 3.16).
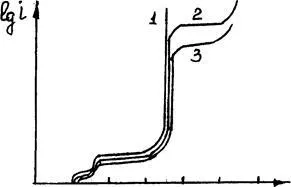
0 0,24 0,48 0,72 0,96 Е, B
Фигура 3.16. Тип поляризационни криви блистерни мед с различни добавки сребро: 1 - блистер мед;
2 - блистер, допълнена с 10% Ag; 3-с, допълнена с 20% Ag
Контрол на потенциал за управление е технология съответствието на качеството на контрола метал, управляващият софтуер на правилните икономически показатели.