Възможните стойности квантово число
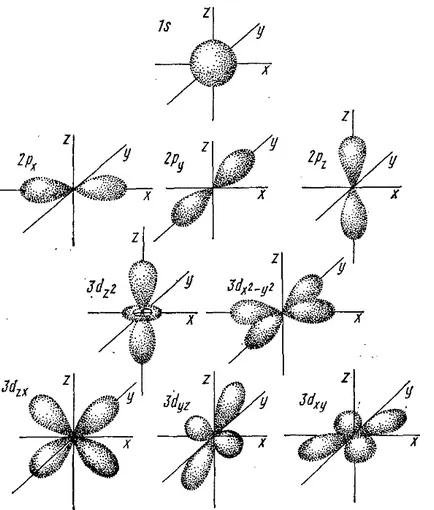
Фигура 5. Формата на електрони орбитите
Четвъртият квантово число, наречено квантова номера на въртене и е обозначен с мс. Тя може да има две стойности: +1/2 и -1/2. мс характеризира собствения момент на импулса (ъглов момент) на електрона.
Пълнене електрони електрон орбитали на много-електрон атома
Шрьодингер уравнение дава възможност за точно изчисляване на енергия на електрона в системата на един електрон (водороден атом). За да се позволи атоми на останалите елементи, че електронните орбитите са същите като водороден атом, и пълнене на тези орбитали с електрони се провежда на три принципа: ниска енергия и правило Pauli Hund на.
Той приема структурата на електронните обвивки на атомите, написани под формата на електронен или електронно графичен формула. Когато попълване на електронните слоеве на атома в стационарна (спокоен глас) състояние поддържа принципа на малко енергия на електрона. съгласно който:
Най-стабилно състояние на електрона в атом съответства на минимума на потенциалната енергия на електрона.
Следователно, попълването на електрона слоеве се излиза от нива, характеризиращи се с ниска енергия. увеличава електронна енергия като количеството на основната и орбитални квантово число (п + L) (първи управлява Klechkovskii). Ако стойностите са същите, първата електрона орбитален е изпълнен с по-малка стойност на основната квантовата номер (втори управлява Klechkovskii) (фиг.6) две орбитали сума (п + L).
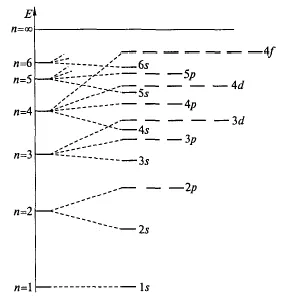
Фигура 6. Промяна на електронните орбити на енергия
Редът на пълнене орбитали на електроните, както следва:
1S 2s 2p 3s 3P 4s 3d 4P 5s 4d 5р 6s 4f 5d 6p 7s 5f 6d
Принцип (забрана) Pauli
Атомът не може да бъде два електрона с една и съща стойност на всички четири квантово число.
От това следва, че във всяка орбитална, характеризиращ се с определени стойности на основната п, L и орбитални магнитни квантово число MS може да бъде не повече от два електрона чиито завъртания са противоположни по знак. Две електрони са в същото орбитални (и характеризиращи се с противоположни завъртания), по-нататък двойка. На завъртания на една посока се нарича успоредни и противоположно насочени - антипаралелен. принцип Паули го прави възможно да се изчисли максималния брой електрони във всяко ниво на енергия и подниво в атома (Таблица 9). Максималният брой на електрони в подниво с квантовата номер орбитален е 2 л (2л 1).
Структурата на всеки електрон слой зависи от стойността на основната квантовата номер. Така, К-слой (п = 1) се състои от само един S-орбитали; L-слой (п = 2) съдържа един 2s-орбитални и три 2-р-орбитален; М-слой (п = 3) се състои от един 3s-орбитални, три 3P-орбитали и пет 3D-орбитали и др електронни капацитет слой определя максималния брой N на електроните в електронен слой, описан по формула ..:
където п - основната квантово число.
Изчислено съгласно тази формула максималния брой на електрони във всеки слой е равен на: 1 за слой - 2, 2-слой - 8, за 3-слой - 18, за 4-слой - 32 електрони.
Разположение на слоеве и електрон орбитите се нарича електронна конфигурация (формула). Когато електронен конфигурация записи точка стойност на основната квантовата номер, а след това - на букви S, Р, D, F - квантовата номер орбитален и буквата в горния десен ъгъл - броя на електроните в орбитален. Последователността на пълнене на електрони орбитали на различни електронни слоеве могат да бъдат представени, както следва: