Valence на елементите - знаете как
§6. Валенцията и видове химични връзки
Валентността на елементите зависи от електронната структура на атома и само се проявява в образуването на химични съединения. Да разгледаме например е оформена от два водородни атома на молекула водород. Както е известно, водороден атом има един S-електрон. Ако лице два водородни атоми, които имат електрони S антипаралелни завъртания, тези електронни облаци може частично да се припокриват помежду си, образувайки електронна двойка,
Фигура 4. Схема на взаимно припокриване на S-орбита-Leu в молекулата на водород
принадлежащи към два водородни атома едновременно, което твърдо свързва двата атоми в една молекула (фиг. 4). Когато образуването на химичните връзки е взаимно припокриване на орбитите. Обикновено социализация електронна двойка в образуването на химични връзки, изобразени както следва:
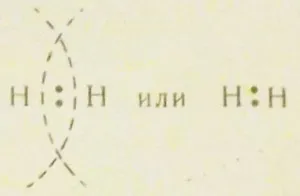
Точките представляват двете приел електрони. Тази химична връзка. образувана от общите електронни двойки се нарича ковалентна връзка.
Въпреки това, връзката ковалентна образуван от чифт S-електрони, се появява само водород. В други молекули, той обикновено се състои от две или р-електрони, облаци, които имат формата на гира или S - и един ред на електрон.
Да разгледаме например образуването на F2 флуор молекула. Флуорен атом е на външния слой на един несдвоен електрон-електронна стр. флуорни молекули води до образуването на взаимно припокриване на две р -electron облаци. Обикновено това може да бъде представен, както следва:
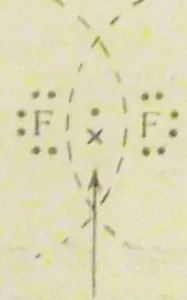
В този случай, това е завършен с външен електронен октет слой на всеки атом. Всяка флуорен атом има свои 6 електрони (принадлежащи на S така и р -SO черупки) и социализирани 2 и 8 на електрони.
Той може да бъде случаят, когато социализирани са не една, а няколко електронни двойки. Например, във формирането на молекула на азот
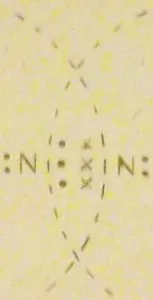
В този случай, всеки азотен атом е по външния слой 2 от своя и 6 (3) двойка социализирани електрони.
■ 35. обяснява образуването на ковалентни връзки в молекулата на хлор Cl2. кислород O2. (Вж. Response)
До сега, ние разгледахме ковалентна връзка, образувана от електроните на двете атомите на едно и също име. Въпреки това, много по-често има случаи, когато такова свързване настъпва между противоположно заредени атоми. Например, в молекулата на метан CH4 това се случи между въглероден атом и четири водородни атома:
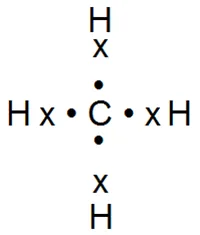
Молекулата на СО2 въглероден диоксид между двата кислородни атома и въглеродният атом:
и т. г.
Valence от елементите на този тип връзка се нарича ковалентна връзка. Например, въглерод в молекулата chetyrehkovalenten въглероден диоксид и кислород - dvuhkovalenten. Големината на covalency на всеки атом определя от броя на електронни двойки, образувани от тях.
Информацията едновременно оформени противоположно атома edektrootritsatelnost ковалентна връзка засяга различни елементи. Atom с по-голяма електроотрицателност, с по-голяма сила привлича общите електронни двойки, които ги предизвикват объркване. Например, в молекулата на метан CH4 споделени електронни двойки са изместени в центъра на молекулата към въглероден атом като повече електроотрицателна, въглероден диоксид в молекулата - към кислородните атоми. Естествено очаква да възникне в близост кислородните атоми
Фигура 5. Схема взаимно припокриване на образуването на химични връзки
излишните отрицателни и близките водородни атоми излишък положителен заряд. Въпреки това, поради факта, че CH4 и СО2 молекули са симетрични, офсетов феномен на електронни двойки не се появява в химически процеси. дядото на ситуация, ако молекулата не е симетрична, като например, солна киселина е солна киселина. Връзката на ковалентна се образува чрез взаимно припокриване на е несдвоени електрони облак от водород и един несдвоен електрон хлор р-облак (фиг. 5). Всички други орбита дали външен електрод хлор сдвоен слой. Обикновено, това се отбелязва, както следва:
Въпреки това, хлор е много по-висока Електроотрицателност от водород, така че общата електронна двойка силно изместен хлор, хлор резултат на отрицателен заряд, и в другия край на молекулата (водороден атом) - положителен заряд. Молекулата се разпознава като два полюса - положителни и отрицателни. Тази молекула се нарича полярен молекула или дипол.
Ковалентна връзка, в която има изместване на електронни двойки по-електроотрицателна атом, наречен полярен връзка. Polar връзка не винаги води до образуването на дипол. Например, в случай на
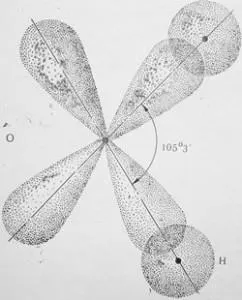
Фиг. 6. Схема на химичната връзка с разтягане ъгъл 105 ° 3 'припокриване с S - и р орбитите в молекулата на водата
образуване на молекули въглероден диоксид изместване електронни двойки се появява, но няма дипол, тъй като молекулата е симетричен. Са асиметрични полярни молекули вода, амоняк, сероводород, и така нататък. D.
Молекулата на вода се образува от един кислороден атом, имащ 6 електрони във външния слой (от които две несдвоен електрон на р), и два водородни атома, имащи една несдвоени електрони и. Както е известно, P - орбитали са разположени около ядрото във взаимно перпендикулярни равнини под прав ъгъл. Когато образуването на връзка се появява взаимно припокриващи р орбитали на кислород водород и У орбити. Когато този S-орбитали на два водородни атоми са отблъснати леко увеличаване на ъгъла между р орбитите на кислород до 105 ° 3 '(фиг. 6). Възникнал ъгъл, наречен ъгъл валентност.
Отместване споделени електронни двойки на силно отрицателен кислород също води до образуването на дипол.
Електроните са въвлечени в химически връзки се наричат валентни електрони. В повечето случаи, електроните валентните са външен електронен слой. Въпреки това, във формирането на химични връзки могат да участват и електрони дълбоко го predvnesh слой.
■ 36. обяснява образуването на полярен ковалентна връзка в молекули НВг, Н2 S. (Вж. Отговор)
Често, ако разликата в Електроотрицателност на елементите е достатъчно голям, това може да стане не само преместване на електрони към по-електроотрицателна елемент, а общият електронен трансфер от един атом на друг. Например, когато химична връзка между натрий и хлорни атоми валентност електрон натриев напълно превръща външен електронен слой хлоро, попълването на vosmielektronnoy структура
Така хлорен атом става излишък отрицателен заряд - 1, превръщането от неутрален атом в отрицателно зареден йон. Натриев атом, като е загубил електрон придобива положителен заряд 1, превръщането от неутрален атом в положителен йон. Противоположно натоварени йони привличат помежду си чрез сила на електростатично привличане да образуват молекула на натриев хлорид. Запишете този процес може да бъде, както следва:
Такава молекула, наречена йонен тъй като е образуван от йони. химичната връзка в този случай се нарича също йонен или electrovalent. Валентността на елементите в тези съединения се наричат elektrovalent-ност.
Molecule йонен тип химически връзки възникнат в случай, когато елементите са свързани атоми с различен Електроотрицателност рязко - типичен типичен метални и неметални. Това могат да бъдат елементи на началото и края на периода.
■ 37. обяснява образуването на йонна връзка в молекулите на калиев бромид KBr, натриев сулфид Na2 S, Mg3 N2 магнезиев нитрид. (Вж. Отговор)
Неполярен ковалентна връзка характеристика на прости вещества - неметални молекули на които се състоят от едни и същи атоми, например име Cl2. O2, N2, и така нататък. D.
Когато е свързан към разлика атоми на неметали, чиито Електроотрицателност е различен, след това неизбежно има полярен връзка. Въпреки това, в зависимост от относителната пространственото подреждане на атомите в молекулата обикновено може да бъде полярен или неполярен.
Например, HCl полярна молекула, тъй като има линеен характер на молекулата на водата H2O като полярен - е плосък с разтягане ъгъл 105 ° 3 '(Фигура 7.). Амоняк като NH3 молекула е полярен, като има формата на триъгълна пирамида с азота отгоре. ъгъл Bond 108 ° (фиг. 8). CH4 неполярен молекула, тъй като тя е под формата на тетраедър с въглероден атом в центъра. Bond ъгъл 109 ° 28 '(фиг. 9). По този начин, полярността на молекулата като цяло зависи от състава и взаимното пространственото подреждане на атомите.
Комплексът молекули често се комбинират различни видове химична връзка. Например, в една молекула Na 2SO 4 натриев сулфат, натриеви атоми са свързани с кислород чрез йонна връзка, и сяра и кислород - посредством ковалентна връзка
Такива примери са много.
Фиг. 7, структурата на молекула вода със Схема разтягане ъгъл 105 ° 3 '
Фиг. 8. структурата на обмен верига с молекула амоняк
ъгъл 108 °
Фиг. 9. структура верига на молекулата на метан на ъгъла на валута 109 ° 28 '
! ■ 38. Сред следните формули IAI Psec вещества с йонни субстанции, полярни и неполярни молекули и обясняват как те са изградени: НВг, Н2 О, CO, рН 3. CAS, ZnCl2. SiH4. CCl4 (Вж. Response)
Други видове химични връзки (метален, по-едър, донор-акцептор) ще бъдат дискутирани по-долу.
Кристалната решетка.
Всичко досега е казано за химическите връзки между съответните само отделни молекули атоми. Но говорим за въпроса, че би било погрешно да се разгледа само отделни молекули, защото те не дават цялостна представа за проблема.
Почти всички твърди вещества при нормални условия са под формата на кристали. кристална решетка структура се нарича. Тя може да бъде оформен като същите или различни части.
В NaCl натриев хлорид кристалната решетка формира йони Na + и Cl - (фигура 10), и поради това се нарича йон. В своите възли са последователно разположени натриеви и хлорни йони. Те са свързани помежду си със силите на електростатично привличане. Кристалът е като едно цяло.
Фиг. 10. Схемата на кристалната решетка на натриев хлорид.
По този начин, в твърдо състояние (в кристали) намираме само йони на Na + и Cl -. Само в газообразно състояние (по двойки) съществува NaCl под формата на молекули.
Фиг. Схема 11. Атомни решетка диамантени
кристалната решетка не може да се образува йони и атома. Например, в решетъчни сайтове диамантени кристали (фиг. 11) от графит или въглеродни атоми са свързани чрез ковалентна химическа връзка. Така, кристалът е като гигантски молекула.
Фигура 12. Схема кристална решетка молекулно йод.
Такава кристална решетка наречен атомен.
Формула прост вещество записва йод I2, подчертавайки, че молекулата на йод се състои от два атома. Местата на решетъчни разположени йод молекули I2 (фиг. 12), така че това се нарича молекулна кристална решетка.
Молекулно кристалната решетка може да се образува не само молекули на прости вещества, но комплекс, като например въглероден диоксид (в твърда форма на "сух лед"), вода (лед твърда форма), и така нататък. D.
Сред всички видове кристални решетки молекулярни - най-крехка, като се провеждат само за сметка на междумолекулните сили на привличане без участието на енергия химична връзка. Най-стабилен решетка - ядрена енергия, където има ковалентна връзка.
■ 39. Защо температурата на водата топене далеч под температурата на топене на въглерода?
40. Тъй като е възможно, знаейки, точката на топене и други физични свойства на материала, стигнах до заключението, за характера на неговата кристална решетка?
41. Каква е разликата на йонни, атомни и молекулно кристални решетки? (Вж. Response)
§ 7. Определяне с помощта на периодичната таблица на елементите и валентност на висшите оксиди формули
Периодичната система на елементите позволява позицията на него елемент намери формула неговите съединения с други елементи, за да се определи естеството на химичната връзка в техните молекули и техните свойства.
Номерът на група от периодичната система е числено равна на най-високата валентността на всеки член на тази група в съединения с кислород. Например, сяра, група VI елемент, е 6 до фосфор елемент на V група - 5, стронций, Група II елемент, - 2. Въз основа на теорията на атомната структура е лесно обяснимо. Външно електрон слой на тези елементи е съответно 6, 5 и 2 на валентност електрон. Когато се комбинира с по-електроотрицателна елемент, като кислород, е оформена като валентните връзки, тъй като има валентност електрони. Електроните значително изместен към най-електроотрицателна атом (например, SO3. Р 2О 5), а понякога (във формирането electrovalent връзки) и напълно отделени и прехвърлени на последните, като по този начин причиняват съединения като високи оксиди SrO, Na2 О и т. г.
По-висока валентност в съединения с кислород, което е числено равно на броя на групата, показва елементите на не само основната група, но също и на страната, въпреки факта, че върху външната електрон слой от атоми е най-често 1 - 2 електрони, независимо от това дали те са в група, , Например, добре известно оксид Mn2 О7. където валентността, манган (Група VII елемент) е равен на 7, въпреки факта, че външният електрон слой 2 има манган атом електрон. Ванадий (V елемент група) в горния оксид V2 О5 показва валентността на 5, въпреки външен електронен ванадий слой има само два електрони. Това се дължи на факта, че химичното свързване включва не само електроните на външния слой, но predvneshnego електронен плик, който не е напълно изградена. Въпреки това, в процеса на извършване на електрона по-дълбок слой се нуждаят от много енергия, затова тези съединения обикновено е по-трудно да се зарежда.
■ 42. Това, което е най-високата валенция в съединения с кислород елементи ниобий, галий, технеций?
43. Това, което е най-високата валенция в съединения с кислород елементи калай, антимон, талий?
44. запис формула високи оксиди на кадмий, галий, хафний.
45. Добави формула на високи азотни оксиди, въглерод, литий.
Възползвайки се от периодичната система на елементите, е възможно да се определи естеството на свойствата на оксид милиона елемент и неговата формула хидроксид. С цел да бъде в състояние да го идентифицира в периодичната таблица на елементите, човек трябва да знае как те са класифицирани и свойства са характерни за тях. (Вж. Response)