Термичното разлагане на алкан, напукване
При температура 500 - 700 ° C разлага до образуване алкани uglevodorov ниско молекулно тегло, съдържаща наситен
кутретата и ненаситени съединения. В този счупени С-С-връзки, а не C-H-комуникация, защото последна енергия празнина е много по-висока. Homolysis ковалентна връзка (реакция 1) води до образуването на два свободни радикали, които могат допълнително да реагират различно. Например, радикалът може да откъсне водороден атом от молекулата на алкан за образуване на алкан с по-малък размер и нов радикал (реакция 2). Новообразуваната пръстен може да бъде разделена на по-малки и алкен радикал (реакция 3).
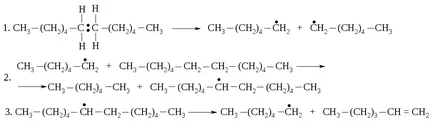
Като резултат от тези реакции, големи молекули се превръщат в смес от алкани и алкени с ниско молекулно тегло.
01.06.16. Йонни реакционни алкани
Най-типичните реакции са алкан радикал заместване, но в някои случаи реакцията може да се извърши с електрофилни реактиви: протон Н +. carbocation СН3 + и др. нитрониев йон NO2 +.
Алкани реагират с superacids на протонни, от които най-често използваните флуоросулфонова киселина FSO2 ОН в смес с Люисова киселина SbF5 а в течна SO2 или SO2 ClF.
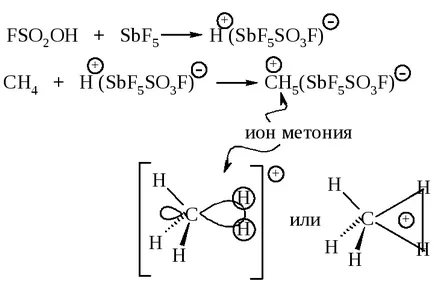
Електрофилно алкилиране се извършва чрез взаимодействие на алкани, съдържащи съединения карбокатиони.
1.7. Методи за синтез на алкани
Алкани могат да бъдат получени в практически неограничени количества природен газ и нефт. Обаче, изолирането на отделните въглеводороди с увеличаване на техния брой на въглеродните атоми е трудно, защото значително увеличава броя на изомерни съединения и едновременно намаляване на разликите в техните физически свойства. Следователно, синтетични методи, използвани за получаване на индивидуални въглеводороди.
1.7.1. Хидрогенирането на алкени и алкини
Ненаситени въглеводороди (алкени, алкини, въглеводороди с няколко множествени връзки) могат да бъдат превърнати алкани чрез каталитично хидрогениране. Като катализатор се използва фино разделен платина, паладий или никел. Такива катализатори се активират от водород, така и алкен.
1.7.2. реакция на Вюрц
В реакцията на първични халоалкани с метален натрий алкани са оформени с два пъти броя на въглеродните атоми. Тази реакция е подходящ предимно за получаване на по-високи алкани симетрична структура.
халоалкани реактивност намалява в реда: R-I> R-Br> R-CI.
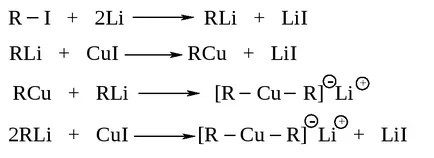
Алкани структура R-R 'може да се получи като се използва модифицирана множествена реакция Wurtz: Взаимодействие LiR2 Cu dialkilkuprata литий с алкил халид R' I. се получават високи добиви, когато dialkilkuprata основно алкилова група или вторични и алкилхалогенид групата - основно.
Dialkilkupraty получава процес на два етапа, реакциите се провеждат в абсолютен диетилов етер.
1.7.3. Хидрогениране на халоалкани
В каталитично хидрогениране на халоалкани в присъствието на паладий образува алкани.
За възстановяване на халоалкани може да се използва като цинк в солна киселина и натрий в алкохол. Iodalkany могат да бъдат възстановени чрез нагряване в запечатана епруветка с HI.
1.7.4. Декарбоксилирането на карбоксилни киселини
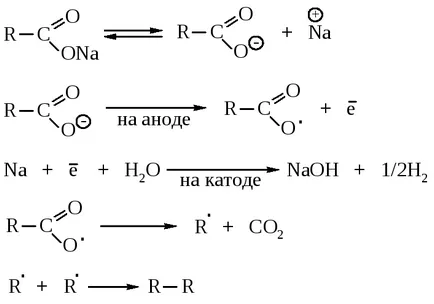
При нагряване, соли на карбоксилни киселини и алкални или алкалоземни хидроксиди на алкалоземни метали с натрий или бариев разцепване настъпва СО2 и алкани.
Уникално, тази реакция протича само за натриев ацетат продукти се образуват в случай на други соли.
В електролиза на натриеви и калиеви соли на карбоксилни киселини са формирани симетрични структура въглеводороди.
В първия етап на анодно окисляване на аниони на киселини до радикали RSOO . който е разцепен СО2. и след това се димеризира. В катод водородът се образува, и хидроксид на алкален метал.
1.7.6. метод Fischer-Tropsch
Каталитично хидрогениране на въглероден оксид протича в присъствие на катализатор, съдържащ кобалт или желязо, за да се образува смес от алкани с ниско молекулно тегло.
2. Стереоизмоерите. енантиомер
2.1. Енантиомера. Хиралността. Условия за хирални

В допълнение към структурни изомери съществува между алкани конфигурационни изомери. Това може да бъде представен от примера на 3-метил-хексан.
въглероден атом, обозначен с С * В, е свързан към четири различни групи. Този въглеводород при същия ред от атоми, свързващи алкиловите групи могат да бъдат различно разположени в пространството около въглероден атом С * на. Има няколко начина изображението на пространствени изомери на равнина (фиг. 2.1, 2.2).
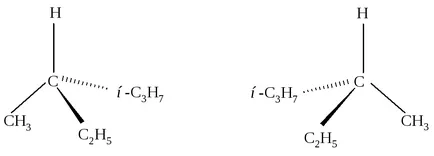
Фиг. 2.1. Триизмерно изображение с помощта на "клинове"
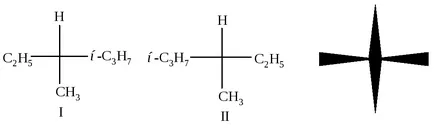
Фиг. 2.2. Фишер проекция формула
Фигура 2.2 в центъра е въглероден атом С * от хоризонталната линия показва връзката между въглероден C * и групи изпъкнали предната плоскост на фигурата, и вертикалната - между С-атом и * групи намира зад равнината на чертежа. Фишер проекция може да се върти само в равнината на чертежа и само около 180. но не и при 90 ° или 270 °. Тези формули са показани две различни съединения. Те се различават един от друг по същия начин, като обект и неговия огледален образ или лявата и дясната ръка. Лявата и дясната ръка - двамата са много близки един до друг по този въпрос, но те не могат да се комбинират (да не се поставя в лявата ръкавица на дясната ръка), а след това - това е два различни обекти.
Две връзки: обект и неговия огледален образ (I и II на), са несъвместими един с друг, се наричат енантиомери (от гръцки "енантио" - обратното).
Свойството на съединенията съществуват като енантиомери се нарича хиралност (от гръцката "Hiroshi" - ръка), и самото съединение - хирален.
Молекулата има хиралност, ако няма равнина на симетрия. Има редица структурни елементи, което може да направи молекула не е идентична с нейния огледален образ. Най-важните от тях е хирален въглероден атом.
Хиралният атом или хирален център - въглероден атом е свързан с четири различни групи, и означават на ми-С *.
2-метилхексан молекула не равнина на симетрия и следователно могат да съществуват като енантиомери (вж. Фиг. 2.1).
Молекула, в която въглероден атом има две или повече идентични групи има равнина на симетрия и, следователно, не хиралност като молекулата и неговия огледален образ идентични. Такива молекули са наречени ахирални.
Например, изопентан могат да съществуват като енантиомери и няма хиралност (фиг. 2.3).

Фиг. 2.3. Ахирална молекула изопентан
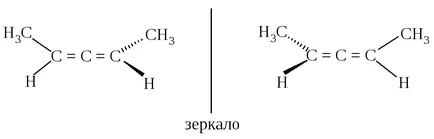
Друг елемент на структурата, което прави молекулата могат да съществуват като енантиомери - хирални Allenes. Молекулата на незаместен allene (пропадиен) ахирална.
Молекулата allene две равнини, в които са разположени на две терминал метиленова група СН2. перпендикулярни една на друга.
Поради този вид заместени Allenes XYC = C = CXY не трябва равнината на симетрия и могат да съществуват като енантиомери.
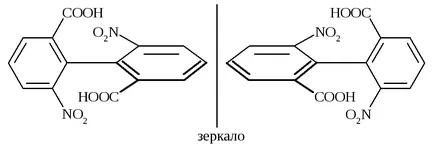
Друг пример може да бъде производни на бифенил в която заместителите на орто-позиции са достатъчно големи, за да свободно въртене оказа невъзможно. Те могат да съществуват като енантиомери, въпреки липсата на хирални атоми. Този вид изомерия, наречена атропоизомери.
Не винаги съединения с не равнина на симетрия, проявяват хиралност и може да се разделя на енантиомери. Например, метилетиламино СН3 (С2 Н5) NH азот има четири различни заместители: Н, СН3. С2 Н5 и свободна двойка електрони, които се намират във върховете на тетраедъра.
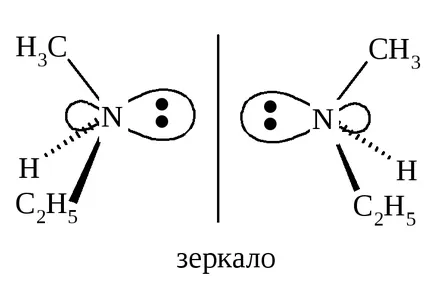
Привидно, такова съединение да съществуват като енантиомери и проявяват оптична активност. Въпреки това, невъзможността да се разцепи амин енантиомери конфигурационен нестабилност поради метилетиламин, един енантиомер бързо се превръща в друг.
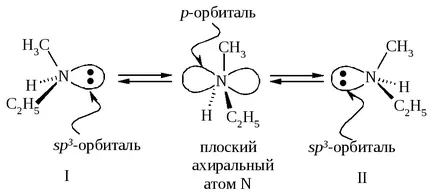
Инверсия пирамида метилетиламин I → II и II → I се извършва през плоска ахирална азотен атом. Следователно, метилетиламин се състои от еквимоларна смес на енантиомери следователно не се разделят на отделни енантиомери и не проявяват оптична активност.
Ако аминът поради неразделен двойка електрони форми връзка, която предотвратява молекула "се окаже", частицата става конфигуративно стабилна.
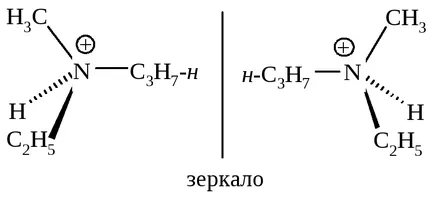
Катион metietilpropilammoniya съществуват като енантиомери.
Следователно, съединения, които не разполагат с равнина на симетрия могат да съществуват като енантиомери и проявяват оптична активност само в случаите, когато те са конфигуративно стабилна.
Енантиомери имат същите физически свойства, с изключение на една. Например, 2-бромобутан молекула съществува като два енантиомера. Те имат една и съща точка на кипене, точка на топене, плътност, разтворимост, коефициентите на пречупване. Разграничаване един от другия енантиомер може да бъде знак на въртене на равнината на поляризираната светлина. Енантиомер върти равнината на поляризираната светлина в същия ъгъл, но в противоположни посоки - един посока на часовниковата стрелка, а другият - в същия ъгъл, но обратно на часовниковата стрелка.
Енантиомерите са идентични химични свойства, скоростта на тяхното взаимодействие с реагенти липсват хиралността е същото. В случай на взаимодействие с оптично активна реагент са различни скорости на реакцията на енантиомери. Понякога те са толкова различни, че реакцията на агента с един от енантиомерите не тече изобщо.