Тема №3 «кинетика на химичните реакции"
Активни молекули и енергията на активиране. Кинетичната класификация на химични процеси.
Скорост хомогенна химична реакция и методи за неговото регулиране (в зависимост от концентрацията, налягане). Законът за действие на масата. Вибрационната отговор.
Зависимостта от скоростта на реакцията на температура. Van't Hoff правило. Арениус уравнение.
Зависимостта от скоростта на реакцията на катализатора. Катализ. Хомогенна и хетерогенна катализа. Механизмът на действие на катализаторите. Катализатори и каталитични системи.
Състояние на химично равновесие. Кинетика на хетерогенни реакции. Влияние на концентрация, налягане и температура от скоростта на хетерогенни реакции. Хетерогенни равновесие.
Фаза на равновесие. фаза концепция. зависими и независими компоненти. фази Гибс Правило-Коновалова. Степента на свобода и променливост на системата.
Всички химични процеси, наблюдавани в природата и се извършват от лице, на практика си дейности се проявяват във времето, срещу определено заплащане. дълбочина Focus и химични трансформации, продиктувани от законите на термодинамиката. Въпреки това, термодинамичен анализ на химични процеси, не отговори на въпросите за скоростта, с която и чрез която междинен етап, системата се е преместил от първоначалното до крайното състояние. Времето на химичната реакция, е предмет на химична кинетика.
Химична кинетика с термодинамиката е теоретичната база на химичната технология, тъй като Тя позволява да се засили и да се оптимизира с търговско значение реакции.
Теоретичната възможност за химическа реакция, не означава, че тя е в действителност. Класически пример е окисляването на органични вещества, които са термодинамично е възможно, дори при ниски температури. Ако тези процеси се случват при съответната скорост при нормални условия на околната среда, това не би било възможно самото съществуване на живите организми.
Например, термодинамични изчисления показват, че водород и хлор при стандартни условия трябва да реагира спонтанно, които водят до образуване на хлороводород. В действителност, смес от тези газове могат да се съхраняват на тъмно в продължение на дълъг период от време и никакви признаци на химическо взаимодействие, ние не се намери. Ако сместа на светлина ултравиолетова реакция се извършва незабавно и напълно.
Друг пример на термодинамичен вероятността от окислителната реакция на водород към вода:
H2 + Уг O2 = Н2 О (ж)
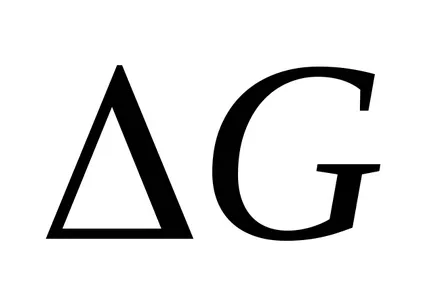
значително по-висока от вероятността от реакцията на неутрализация да образуват вода:
Н ++ ОН- = Н 2О (ж)

В същото време, първата реакция при нормални условия едва ли се случи без катализатор, а вторият се извършва почти мигновено.
Химически кинетика - разрез на химията, която изучава механизмите и размера на химични процеси.
Въпрос 1. активността на молекулата, и енергията на активиране
От химическа реакция - е процес, при който разкъсването на съществуващите химични връзки и образуването на нови. Това е да се въведе такава следва процес:
Сблъсък взаимодействие частици (атоми, молекули или йони);
Наличието на тези частици достатъчен резерв от енергия;
Оптимално положение на частиците спрямо друга в пространството.
Сблъсък на две или повече частици с достатъчно висока енергия, позволява да се преодолее взаимното отблъскване на електроните и за осигуряване на необходимата степен на взаимодействие на контакт. В този случай, химична реакция настъпва.
Скоростта на реакцията се определя чрез броя на колизии (елементарни реакционни действа) причинява химична конверсия за единица обем за единица време.
Въпреки това, не всеки сблъскване резултати в химическата взаимодействието на молекулите. Нека да помислим. 1 мол от всеки газ заема обем при STP 22,4l, който съдържа 6.02. 23 октомври молекули. Така, 1 cm 3 от газ, съдържаща

по този начин Скоростта на реакцията не се определя от броя на общите сблъсъци за единица време, и броя на колизии активни молекули. Активна молекула - молекула, притежаваща повишено съдържание на енергия в сравнение със средната енергия на молекулите на същите вещества. Разликата между енергийния резерв на активните молекули и средната енергия на молекулите на този вид в тези условия се нарича енергията на активиране. по този начин активиране енергия EAKT. (J / мол) е количеството енергия, която трябва да бъде докладвана на молекула със средно акумулирана енергия да активната молекула за реакцията.
Теоретичните изчисления на Максуел и Болцман (1880) показват, че при определена температура газови молекули на тяхната скорост (и, следователно, кинетичната енергия) са разположени по определен начин, разпределението не се променя във времето, въпреки факта, че всяка отделна молекула непрекъснато променя неговата скорост (закона на Максуел-Болцман разпределение).
Според този закон, винаги има молекули с достатъчно висока енергия за преодоляване на енергийната бариера.
Фигура 1. Т1, Т2, Т3 три различни температури; Е е енергията на активиране, и защрихованата област характеризира броя на активните молекули. С увеличаването на крива на разпределението температура измества надясно, и значително увеличава делът на активни молекули и скоростта химична реакция също се увеличава.
Механизмът на химическата реакция може да бъде представен графично, ако ордината енергия на системата, и по абсцисата - реакцията (Фиг.2).
Ако напред реакция (т.е., преход от състояние I да посочи II) е екзотермична, общата енергия доставка на реакционните продукти по-малки от изходните материали, и системата като резултат от тази реакция протича при по-ниско ниво на енергия. Разликата в нивото I и II е равна на термичен ефект на реакцията

Активиране молекули могат да се появят не само чрез повишаване на температурата, но също така и под въздействието на лъчиста енергия, електрически разряд, ултразвукови вълни, йонизиращо лъчение.