Сребърен халогениди - химически енциклопедия 1
Сребърен халид. флуориди състав AG2 F, AgF и AgF2 и сътр. халид състав AgX (вж. таблица.).
Gemiftorid AG2 F при отопление. над 90 ° С, и когато се разтвори във вода се разлага с образуването на AgF и Ag; диамагнитно; т. б. получен чрез UV облъчване AgF. Флуорът AgF хигроскопичен; добра разтворимост. във вода (172 г на 100 г при 20 ° С); система AgF-Н 2О температура евтектична -14,2 ° С (37.5% от теглото на AgF); до 18,6 ° С в равновесие с р-ром (62,9% от теглото на AgF) е тетрахидрат AgF · 4H2 О (-1387,8 кДж / мол, -1,145.6 кДж / мол) до 39,5 ° C (68,95% AgF) -digidrat AgF · 2Н2 О (-801,6 кДж / мол, - 669.9 кДж / мол), 39,5 ° С над безводен сол. AgF2 бифлуорид разлага до образуване вода AgF, HF, O2 и О3 примеси.
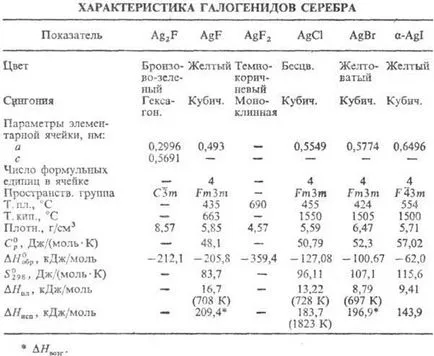
Хлорид (минерално hlorargirit или cerargyrite, рог сребро) AgCl в газова фаза е под формата на моно-, ди- и тримерна не молекула зол. във вода (продукт на р-ри мост 1.8 х 10 -10) зол. в края. Н N О3.
Бромид (минерално bromargirit) AgBr до 259 ° С съществува в кубичен. кристална. модификация, над 259 ° С в rombich. не Сол. във вода (продукт на р-rimosti 5,4 х х 10 -13).
Йодид (минерално iodargirit) Agl съществува в няколко. кристална. модификации: до 136 ° С е стабилен на -Agl, в интервала от 136-147 ° С-хекс. -форма б (а = 0.4596 пМ, с = 0.7500 пМ, Z = 2, пространства. Група F 63 п) над 147 ° С-кубичен. грам-модификация; не Сол. във вода (продукт на р-rimosti 8.5 х 10 -17) зол. в етанол.
С, разтворимостта. излишък халид-ЛИЗАЦИЯ съответстващ на m-халогенидни комплекси да образуват, те също са зол. р-ма цианиди и тиосулфати алкални метали и амоняк, за да образуват комплекс йони Ag. С се намалява до Ag неорганични соли. (Pb, Zn, Mg, Н2) и орг. (Хидразин, формалдехид, хидрохинон, и други подобни) редуциращи агенти. Под действието на светлина се разлагат с освобождаването на Ag °; AgF чувствителност висока от тази на AgCl.
С се получава взаимодействие. Ag и халогени в присъствие. вода, както и обработка на Ag конц. Вода рами р-хало-т-едър и за обмен на взаимодействие. между р - разтворима сол на Ag и съответния метален халид.
За регенериране на Ag DEC. С отпадъците се използват, за легиране с карбонати на алкални метали. С г (AgCl, AgBr, с Agl) се използва за получаване svetochuvstvit. емулсии в производството-ве филм и фотографски материали. Тъй като AgCl елементи, произведени оптика за инфрачервени спектрометри, космически датчици. лъчения. AgBr катализатор при получаването на някои карбоксилна к-т. AgF, с Agl и двойни йодиди на алкални метали, и Ag имат висока йонна проводимост в твърдо състояние и се използват за производство на твърди електролити, и сензори. AgF използва като компонент на фосфора и флуориращо средство в Org. синтез, с Agl-с галванично. посребрено, за да се образува iskuss дъжд и сняг от буреносните облаци. P. М. Chukurov.
===
App. Литература за статия "сребърен халогенид" на. неизвестен
Page "сребърен халид", изготвен на базата на химически енциклопедия.