Ръководство за бързо калций, алкалност, магнезий и рН
Бързо Ръководство: калций, алкалност, рН и Mg
Прекалено опростено описание на взаимодействието на тези параметри е по-лесно, но понякога само усложнява разбирането. За съжаление, неточна опростяване често води до погрешни изводи. Така че, твърде опростено понятие, че общата концентрация на калций и алкалност, която може да бъде постоянен в морската вода, имат обща горна граница може да доведе до неправилни интерпретации.
Например, често ми задават въпроси като:
Какво по-лошо, този вид заблуди може да доведе до това, което някои акваристи просто изоставени опитите им да разберат, химичните процеси, които протичат в аквариума; опростена интерпретация често води до погрешни изводи лицемерие, което е очевидно, дори и от гледна точка на практиката.
Калций - е един от най-големите йоните на морска вода. Неговата концентрация в нормален морската вода е около 420 части на милион. Така калций е по-малко от 1.2 тегловни% от теглото на твърди вещества на морска вода. В океана, този промени концентрация обикновено се дължат на изменения в соленост, съответно, промени в концентрацията на калций нива napryamuyusvyazany вода соленост. В морска вода, на калциев йон носи два положителни заряди означени Са ++.
калций риф akariume играе важна роля, тъй като много организми, включително и корали и коралово водорасли, които го използват, за да формират основата. Недостатъчните нива на калций причинява увреждане жизнената дейност на тези организми, те могат дори да умре. Препоръчвам запазване на концентрацията на калций в аквариум риф на ниво 380-450 части на милион.
Алкалност - е от комплекс фигурата. Това - не "неща", който се намира във водата. Алкалност е съвкупност от много вещества, които осигуряват специфични химични свойства. Причината за измерване на алкалността любители е, че при нормална морска вода, се състои по същество от карбонат и бикарбонат. Коралите консумират бикарбонат (HCO 3 -) и да го превърне в карбонат (CO 3 -), необходими за формиране на скелета. Съответно, това е индикация, алкалност достатъчно или недостатъчно, съдържанието на бикарбонат.
нива алкалност в нормални граници, или по-висока, доказателство за достатъчно съдържание на бикарбонат, докато най-ниската ставка казва за липсата на бикарбонат във водата. При липса на специални добавки, за да се поддържа нивото на алкалност в риф аквариум ресурс бикарбонат във вода бързо изчерпани. В отделни аквариуми Reef спад алкалност от нормалното за неприемливо ниско ниво може да отнеме по-малко един или два дни, въпреки че в аквариуми с по-малка нужда карбонат в този процес ще бъде по-дълго. Както изчерпването на бикарбонат на ресурсите в корали консумират липсва вещество необходимо за тяхното съществуване, и дори може да умре. Препоръчваме аквариумни urvoen поддържат алкалност в (7-11 DKH. Което е еквивалентно на 125-200 ррт калциев карбонат) 2.5-4 милиеквивалента / L.
Тъй като много корал, корал водорасли и други организми калцират изисква калций и алкална среда (бикарбонат), трябва да се поддържа желаната концентрация на тези елементи. За съжаление, има естествена тенденция към утаяване на неразтворимия калциев карбонат на абиотични (небиологичен) утайки като калциеви йони и карбонатни йони са комбинирани. Подобна тенденция към утаяване играе важна роля във взаимодействието на концентрацията на калций и алкалност в аквариум риф.
Преди обсъждане разтворимост и утаяване, утаяване на съединение като калциев карбонат, помисли за прост случай. Например, натриеви и хлорни йони се комбинират за образуване на твърдо вещество - натриев хлорид (готварска сол). Представете ако долната част на натриев хлорид в прясна вода (Фигура 1). Той е разтворим до степен, че йоните, напускащи повърхност (Фигура 2).
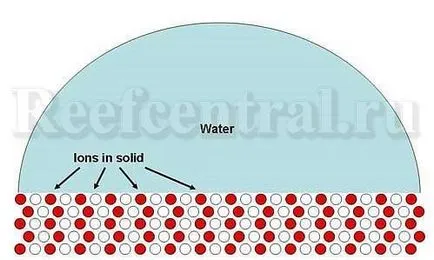
Фигура 1. Схема на обикновен твърд продукт (натриев хлорид) във вода. натриеви йони (червено) и хлорид (бели) образуват подредена структура на твърдо вещество.
Фигура 6. графично представяне на относителната концентрация на бикарбонатни йони (зелен) и карбонат (червено) в разтвор в зависимост от нивото на рН. С увеличаване на рН, увеличаване на размера на йони на общия брой е представен като карбонат. Относителната стойност представлява съотношение на двата йони при различни нива на рН (алкалност също се увеличава, тъй като един карбонат ниво йон на алкалност осигурява двойно в сравнение с бикарбонат йон).
По този начин, като се променя нивото на рН, така че няма концентрация на карбонатни йони в разтвор. Тъй като концентрацията на карбонатни йони засяга нивото понижаване на карбонатни йони на повърхността, така че с повишаване на рН, карбонат ще потъне на повърхността по-бързо. Това означава, че от своя страна, толкова по-висока рН, по-ниска разтворимост на калциев карбонат.
Ниска разтворимост означава, че утаяването на калциев карбонат като утайка може да бъде по-интензивно при по-високо рН. С други думи, чрез повишаване на рН, концентрация на калций и основи, които могат да присъстват в разтвор без утаяване намалява.
Това обяснява, например, поради повишаване на рН до високи нива, използвайки варовита вода bysro може да улесни утаяването на калциев карбонат преципитат. Това се дължи не на факта, че вар вода добавя значително количество калций или алкален, въпреки че може да играе роля, както и рН се увеличава, и голяма част от наличната вода в хидрогенкарбонат форма влиза и концентрацията на карбонатни увеличава.
Обратно, при падането на нивото на рН на калций и основи, които могат да присъстват в разтвор без утаяване увеличава. Този ефект обяснява, например, поради намаляване на рН се използва въглероден диоксид може да се разтвори калциев карбонат в реакцията на калциев карбонат / въглероден диоксид. При рН 6.5 карбонат концентрация 50 пъти по-ниски от нивото rN8.2; по този начин намалява скоростта на карбонатни йони е значително намалена. Това намаление на скоростта позволява повече от калциев карбонат, разтворен във водата преди състоянието на насищане, когато процесът на разтваряне спира.
Този ефект е свързан с редовност, което може да обърка доста акваристи. При ниско рН (например, 7.8) в разтвор може да се поддържа високо ниво на калций и алкалност отколкото при по-високо рН (например, 8.5). Поради тази причина, любители, в аквариуми, чието рН ниска, често казват, че нямам проблем за поддържане на високо ниво на калций и алкалност, и те рядко се отстраняват чрез утаяване калциев карбонат от помпата, а любители, подкрепящи по-високо рН. Те не разбирам защо те не могат да се създадат условия във вашия аквариум, и защо толкова често запушват помпи. Основната причина за тази разлика е в по-голяма концентрация на карбонат при високи нива на рН (друга причина може да бъде, че консумира големи количества корал калций и алкалност вече при по-високи нива на рН, тъй като най-високи стойности на рН корали могат да се втвърдяват по-бързо). Въпреки това, не мисля, че ниското ниво на рН е по-добре, защото тя е по-лесно да се поддържа нивото на калций и алкалност и запушвания помпи по-бавно. Ниската скорост е стресиращо за корали поради това, че те трябва да бъдат сушени при ниско рН. Трудността тук е, че корали трябва да изпомпва протон (Н +) по време на производството на водород карбонат и понижаване на рН, по-Н + присъства в разтвора, и по-трудно да изпомпва излишък Н +.
Разтворимостта на калциев карбонат зависи също алкалността на водата. По-високата степен на алкалност (рН на постоянно ниво), толкова по-висока концентрация на карбонат (Фигура 7). В действителност, на нивото на карбонат е право пропорционално на нивото на алкалност. По този начин, когато нивото на алкалност равна на 5 милиеквиваленти / L (14 DKH), карбонат концентрация два пъти по-висока, отколкото в нормална морска вода до нивото на алкалност на 2.5 милиеквивалента / L (7 DKH).