Рибозимите като лекарства
Въз основа на резултатите от гледането, както и други натрупани познания за разви рибозоми становището на около възможността за използване на рибозоми за регулиране на дейността на някои човешки гени. Обхват на рибозоми като лекарствата може да бъде много широка. Възможните областта на употреба в клиники се обмисля лечение на вирусни инфекции, рак, за които са известни продукти от онкогени, както и патологични състояния, причинени от свръхекспресията на специфични гени.
Друг подход за преодоляване на HIV инфекцията е разцепването на 5'-крайната капачка структура на HIV РНК от рибозими на. Известно е, че по-голямата част от HIV изолати 5'-крайната водеща последователност на геномна РНК е добре запазена. От всички известни изолати на щам MN съдържа само един нуклеотид заместване в лидер област РНК разцепва рибозима на. В същото време изследвани щамове на ХИВ варират в други части на лидерната последователност 5'-терминал. отстраняване ендонуклеазата като част от олигонуклеотид 5'-крайната затваряща група на HIV РНК на потиска транслация на РНК и го прави по-достъпни за целевите вътреклетъчни нуклеази. Всички наличните експериментални данни ни позволяват днес да се направи заключение за перспективите за използване на 5 'края на водещата последователност на HIV РНК като цел за рибозоми.
Основната трудност за преодоляване при проектирането на рибозоми, разкъсвайки геномна HIV РНК е високата изменчивост на РНК. Поради нуклеотидна замяна мутацията на единична в сайтове, която разцепва РНК рибозим, последният губят своята активност по отношение на тези РНКи и съответно антивирусна активност. Последната стратегия за справяне с този проблем е да се създаде няколко рибозоми, насочени срещу различни запазени региони на HIV генома, отделните рибозимите следва да бъдат включени в една молекула на рекомбинантна РНК ( "пушка последователност"). В допълнение към антивирусни рибозимни последователности, такива рекомбинантни РНК съдържат цис -action допълнителни рибозими, които извършват обработка автокаталитични рибозимни антивирусни прекурсори с освобождаването на зрели рибозими, действащи на различни части на вирусния геном. Този метод не позволява на вируса на ХИВ, за да се избегне инактивиране действие на рибозоми от мутациите променя неговия геном.

Фиг. II.26. Използване на рестрикционни места за изграждане на рибозим, антисенс РНК е интегриран в
Неотдавна касета се получава от девет идентични рибозим ген разположени един зад друг по същия експресионен вектор. Рибозимите такъв "полицистронен" РНК насочени срещу различни части на HIV генома, поддържани в своята специфичност на клетки, но са по-ефективни по отношение на едно копие на poliribozima РНК и не губи активността си дори при частично влошени РНК молекули.
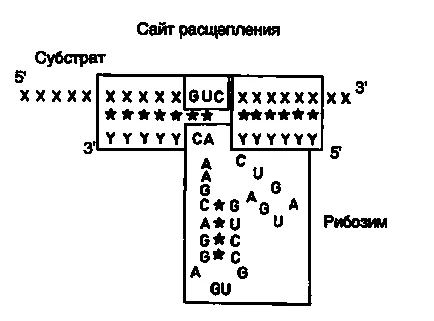
Фиг. II.27. Взаимодействие с рибозим РНК субстрат
В заключение на този раздел, помислете за един пример за използването на рибозоми срещу растителни вируси в селското стопанство. Както бе споменато по-горе, рибозими, образувайки тип "чук" структура разпознават мястото на разцепване в целевата РНК последователност от три нуклеотида в непосредствена близост до настъпва хидролиза РНК нишка. Подобни тринуклеотидни последователности могат да бъдат AUC, CUA, CUC, GUA, GUC, GUU и UUC. В предложения подход, РНК свързващ домен на рибозима се конструира по такъв начин, че разпознаваема част на тринуклеотид последователност от нуклеотиди в двойно-верижна ДНК, която образува рестрикционен сайт. Този подход позволява да се включи рибозим последователност каталитичен домен на рестрикционния сайт в сДНК, получена чрез обратна транскрипция на РНК мишена. Следователно каталитичния домен на рибозима е фланкирана от последователности на антисенс РНК, комплементарна на таргетната РНК, която автоматично изпълнява ролята на РНК-свързващ домен. При този подход елиминира нуждата за синтез на голям брой олигонуклеотиди, и във всеки случай е необходимо рибозим се сглобява от сглобяеми блокове. Като конкретен пример, помисли за изграждането на рекомбинантен рибозим специфично разцепване на РНК, съдържаща последователността на рестриктазно място Sal I (фиг. II.26). След разцепване на ДНК с рестрикционен ензим Sal I (етап 1) на получения "лепкави" завършва хидролизиран нуклеаза S1 (стъпка 2) и образува "тъпи" краища добавя рибозим каталитичен домен затворена в двойноверижна ДНК фрагмент (етап 3). В резултат на тази конструкция се синтезира записване на антисенс РНК, която е включена в състава на каталитичния домен на рибозима. След хибридизиране с целевата РНК форми двойно-верижна РНК молекула, една от които е образувана от вериги от тип рибозим структура "чук" (фиг. II.27), отцепване на прицелната РНК в специфично място. Описаният подход е изпълнена в дизайна на рибозим насочена срещу РНК генома на вируси от сливи. По този начин се получава рибозим последователност от нуклеотиди, подходящи за използване с други 25 рестрикционни сайтове.
Потискане на онкогенна функция. Една от основните разлики открити между нормални и ракови клетки са генетични различия от няколко гени, които контролират пролиферация. В генома на туморни клетки често проявяват мутации в гените на два вида: онкогени и тумор супресорни гени на растеж, или анти-онкогени. Онкогени еволюционно консервативни и индуцират неопластична трансформация на клетки, както в ретровирусна инфекция при естествени условия (тъй като те често са включени в ретровирусния геном), и след въвеждане на ДНК в онкоген култивирани клетки чрез трансфекция. Повечето онкогени първоначално открити в състава на генома от онкогенни вируси, и те са мутантни производни на прото-онкогени, които се намират в здравите клетки на многоклетъчни организми и се активират по време на ембриогенезата, клетъчния растеж и възстановяване на тъкани. Тъй като активирани онкогени в туморни клетки, обикновено свръхекспресирани и РНК, кодирана от поради тяхната първична структура се различава от протоонкогените РНК, РНК онкогени са добър потенциална мишена за рибозоми.
Oncogene H-Ras. Мутацията в кодон 12 ген H-Ras. което води до подмяна GGCGUC създава консенсус сайт, на която HH-рибозомата може да разцепи мутант иРНК. Ин витро се демонстрира чрез пет-кратна разлика в ефективността на рибозима в мутант H-Ras РНК и съответния див тип РНК. Получават H-Ras -зависима клетъчна линия, стабилно трансформирани с експресионен вектор, който насочва синтеза на HH-рибозим под контрола на промотор -актин ген. За тези клетки намалени процент пролиферация характеристика, свързани с намаляването на вътреклетъчните нива на H-Ras РНК и р21 протеин, кодиран от този ген. Освен рибозим изразена в клетъчна линия EJ карцином на човешки пикочен мехур. Въвеждането на стволови клетки в мишки бе придружено от тяхната бърза смърт на фона на силно агресивни тумори. За разлика от клонове EJ-клетки, експресиращи рибозима в тялото на мишки бяха значително намалени тумор фенотип. Получените туморите са минимално инвазивни и се наблюдава в приблизително две-кратно повишаване на оцеляване на мишки, присадени. Хистологичните изследвания потвърждават лошото способността на туморите да метастазира. Рибозими тумори се откриват чрез PCR за 86-90 дни. По този начин, тези и други експерименти показват способността на рибозими за нормализиране на експресията на активен H-Ras както ин витро и ин виво.
Onkogenc-FOS. Както е посочено в Част I, протеин генен продукт С-FOS се състоеше в еукариотни клетки предаване на сигнали, участващи в синтеза на ДНК и могат да придават устойчивост към клетки противоракови лекарства. Последните две свойства на този протеин се потвърждават, по-специално в това, че по време на лечението на често използваните противораково лекарство цисплатина (цис-diamminedichloroplatinum) се появява в ген-FOS индукция след dTMP-синтазни гени и ДНК полимераза. А рибозим, което затруднява с-FOS иРНК намалява експресията ниво ген на крайните С-FOS. доведе до повишена чувствителност на туморни клетки към хемотерапевтични агенти (включително цис-платина) и значително потиска експресията на гени dTMP-синтаза ДНК полимераза и човешки металотионеинов ген hMTII-A.
Oncogene BCR / ABL. Нетипично Филаделфия хромозом се образува чрез преместване (9; 22) (q34; q11) в стволови клетки от костния мозък, които се придружават от слят ген BCR и ABL онкоген за образуване на химерен BCR / ABL и развитието на хронична миелоидна левкемия (CML). Транскриптът на химерен ген кодира протеин р210 BCR / ABL. който има подобрена тирозин киназна активност. Такова РНК и протеин са открити в почти всички пациенти със синдром на CML, както и 50% от пациентите с остра лимфобластна левкемия, които имат Филаделфия хромозом. С рибозим специфично разцепване химерен иРНК в място докинг секвенции на двата гена е в състояние да потискат експресията на BCR / ABL химерен ген в култивирани клетки. Експресията на рибозими в култивирани клетки, причинено намаляване на BCR / ABL ниво иРНК, напълно блокира образуването на химерния протеин р210 BCR / ABL и инхибира клетъчния растеж с 84%. Тези резултати са значително по-добри ефекти, предизвикани от антисенс олигонуклеотиди.
В други изследователи се получава рибозимни разцепва горе химерен РНК кодон GUU, разположен в непосредствена близост до база докинг последователности на двете гени. Това рибозим унищожаване РНК подходящи ин витро и ин виво, и инхибира тирозин киназната активност на P210 протеини.