Разпрашаване енергия ковалентни кристали
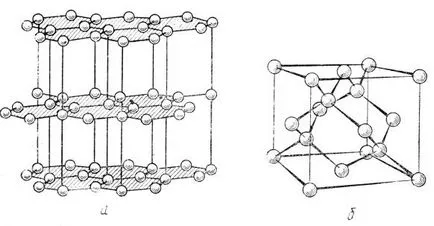
Фиг. 37. графит структура (а) структурата на диамант (б)
Графит структура (.. Вижте Фигура 37 а) типично за борен нитрид BN, който се движи при високи налягания в диамант кубичен структура от типа сфалерит (фигура 37 Ь.), Всеки от четиристенен околната среда, което показва, техните атоми SP 3 - хибридизация. Горният потвърждава, че SP 2 - и SP 3 - хибридни орбитали не са изключителна собственост Група IV атоми, те са възможно да съседни атоми III и V групи.
Енергия съединител атоми свързани чрез ковалентни сили, измерени по време на дисоциацията на молекулата или кристал сублимация за да се образуват едноатомен газ. Следователно, енергията на свързване ковалентна на кристала може да се нарече енергия пулверизиране. да се разграничи от йонната решетка енергия, която се освобождава по време на образуването на кристали от йоните на газ.
Проблемът на теоретичното изчисляването на енергията на ковалентна връзка е много сложно, тъй като тя е изправена пред трудности при решаването на квантово-механичен проблем на много частици. Поради това, до сега много често има различни методи за оценка на емпирични енергия ковалентна връзка. Опитът показва, че равновесната енергията на обикновен хомеополярно комуникация е доста проста линейна функция от дължината му. Тази връзка може да бъде изразена от приблизителното уравнение: Е (ккал) = - 38 R (А) 136. За елементи от IV група (С, Si, Ge, Sn) безплатно
Терминът в това уравнение малко по-голям: E (ккал) = - 38 R (А) 143.
Енергията на множествена връзка, обикновено не е просто парче обикновена свързваща енергия и мултиплициране. Например, енергията, необходима за да се разчупи единична връзка C - C
е 84, двойно - 141, и тройна - ккал 187. Можете да видите, че пи -връзките много по-слаба σ -връзките, вторият π-връзката е по-слаб от първия. Затихване π -връзките компенсира чрез съкращаване на множествена връзка в сравнение с проста σ -връзките. Така обикновената енергия, двойни и тройни връзки между С и N съдържа 73, 142 и 210 ккал / мол, т.е. са в съотношение от около 1: .. 2: 3 дължи на скъсяването на дължината на връзки в този ред към 0,35 А ,
Енергийна ковалентни взаимодействия между различните елементи обикновено се оценяват по постулат на средната аритметична стойност на Полинг:
Може да се отбележи, че като се използва полу-емпирични молекулно орбитален метод обосновка на приблизително равенство е намерено (12), и поради своята простота, практически е много удобно. Например, енергията на ковалентна взаимодействието между Li и S е равна на E (S-Li) = 1/2 (28 + 55) = 48 ккал.
5. СЪОБЩЕНИЕ междинен между йонно и ковалентно. Ionicity комуникация.
Електроотрицателност и ionicity.
За да се обхванат всички възможни преходи между максималните йонни и ковалентни връзки в крайна сметка, Полинг въвежда понятието през 1932 г.
Електроотрицателност атом и степента на ionicity ε химическо свързване, което може да варира от 1 до 100%, или йонно свързване на 0 - за ковалентно. Електроотрицателност атом характеризиране на способността на молекула (кристал) за привличане на електрони. От това много общо определение, следва, че по-голямата реанимацията на елемент, толкова повече той се запазва като цяло електронната двойка благодарение на своята черупка. Лесно е да се разбере, че ЕА на стойности е по-голям за елементи като халогени (F, CI, и т.н.) и кислород, и най - за алкален метал (CS, Rb, К, и т.н.).
Полинг построен мащаб ЕО от произволна отправна точка по този начин
EO елементи на втория период на Li до F са в диапазона от 1.0 до 4.0. EO стойности са дадени в приложение 1-8.
Между ЕЕ Полинг χ P и χ орбитален ЕО Mulliken съществува М
приблизително пропорционалност: χ M / χ п от 2.8 ЕГ. Например:
където алфа параметър е около 0.2. Къде ε - ionicity и £ -
степен на covalency (homopolarity) връзка. Уравнение (13) е отражение на факта, че с увеличаване на ЕО разлика Δ χ увеличава ionicity връзка.
Уравнение (13) може да се прилага по същество ковалентни кристали, където първият координация броя съвпада с официалната валентността м. Д. За всяка връзка локализиран електронна двойка. Например, BN с слоеста структура от тип графит QP = 3, когато валентността на В и N. Тогава се получи след оценка на ionicity на връзката в този кристал:
ε (BN) = L -exp [-0,2 (3,0 - 2,0) 2] = л - ехр (-0,2) = 0,18.
С други думи, във връзка с графит структура BN има 18% йонен характер.
Въпреки това, в повече йонни кристали CN обикновено по-голямо официално валентност и делокализирани електрони двойки. За такива случаи уравнение (13) дава по-ниска граница на степен на ionicity връзка. Както Полинг приема пропорционална на степента на делокализация сила (или множество) за комуникация S = Z / ν. където Z -
валентност и ν - номера на координация. След това уравнение (13) приема формата:
ε "(AB) = 1- ξ = 1- (Z / ν) отл [- α (Δ χ) 2].
Например, че за кристалната структура BN тип диамант и четиристенните среди два атома, които могат да бъдат получени от слоеста модификация при високи налягания, S = 3/4 и ε = 0,38. За молекули LiF CN = 1 и ε = 0,83 (13), и за
кристал QP = 6, S = 1/6 и ε '= 0,97 (14).
Съобщение атомизация енергия и кристалната решетка на енергия.
Възможно е да се качествено определяне на промяната (увеличаване или намаляване) степента на ionicity на връзката в серията от съединения с обща атом, например брой MX чрез замяна само на М (или просто X) без затруднения. След това, очевидно, на ionicity е по-голямата EO (М) или по-висока от потенциала йонизация на I (М).
Забележете, че за всички кристали освен халогениди и хидриди, поради липсата на афинитет към електрони до два О, S и други аниони могат да се определят експериментално само енергия Е. пулверизиране която се освобождава по време на образуването на кристал атоми на газ в съответствие с термохимична цикъл :
Е = Δ H F + Σ Δ Н атом.
Може да се види, че разликата между енергията решетка и енергията на пулверизиране е равна на сумата от алгебрични потенциали на йонизация и електрон Афинитетите на всички атоми в кристала.
6. лента структура енергия на кристали: диелектрици, полупроводници и метали.
Структурата на такива молекули като Li 2. Na 2 и др. Е много подобна на структурата на молекулата
H 2. σ-връзка между атомите се извършва поради припокриващи и орбитали атоми. Различна ситуация възниква при кондензацията на тези молекули и образуването на кристали. Резултатът е появата на огромен брой мултицентрови орбитали, които улавят цялата кристала и отделни нива, в който са разположени електрони в изолирани атома, при образуването на кристал дифузно в цялата енергия лента, както е показано на фиг. 36. Вътрешните електроните на атомите не взаимодействат и техните скелети малко припокриване и съответната зона е слабо разцепва. Следователно, вътрешните електроните остават локализирани атома в техните ядра (крива 4). Валентен електрон, а напротив,
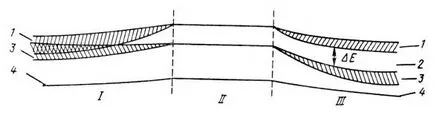
взаимодейства силно и съответните нива на енергия да се широка лента - валентната зона (крива 3). Над него е зона, която може да бъде потенциално заета от електрони, и се образува от множество необвързващи орбитален - проводимост (крива 1).
Фиг. 38. Конструкция за схема на взаимните енергийните зони: I - метални, III - на полупроводникови и диелектрични; 1 - проводимост зона 2 - Bandgap, 3 - валентността, 4 - вътрешния слой. II - нивата на изолиран атом, Δ Е - Bandgap (2).
Ако между тях съществува липса на енергия не заета от електрони, тя се нарича забранената зона. Ширината му е означен с E г (или Δ Е); той е маркиран с номер 2 на фиг. 36.
валентната зона не се припокрива с проводимата зона, когато стойността на E г
значително по-голяма от топлинната енергия (при стайна температура ≈ 0,1 ЕГ). Този случай съответства на формирането на диелектрици и полупроводници. Примерни диелектрици имат между двата йонни кристали като LiF и CaF 2 (Δ Е = 12 ЕГ) и включват ковалентни кристали като диамант (Δ E = 5.3 ЕГ).
Типични полупроводници - кристали с структури като диамант сфалерита: Ge (0,75), Si (1,12), AlSb (1,60), CdS (2,3 ЕГ). На границата между диелектрици и полупроводници SiC е Karbid Kremniya (3 ЕГ). В горните случаи, валентност групата на кристала е напълно заети. Например, в случай на йон диелектрик (LiF, Кафе 2. MgO, натриев хлорид и др.) Валенсия лента е запълнена с електрони локализирани на анионите и празен проводимост свързани с свободните орбитите на катиона. В диамантени полупроводници и с подобна структура на валентната зона е напълно заети от електрони, който може да се счита като локализиран на два електронни връзки, образувани насочени SP 3 хибридни орбитали на съседни атоми. Сега става ясно защо всички ковалентни твърди частици, се подчиняват на правилата на Хюм-Rothery CZK = 8 - Н. не може да бъде проводници. В действителност, ако това правило е изпълнено, всеки атом има възможност