Размери атоми на различни химични елементи
Начало / теоретичните основи на химия / § 1.3. Размери атоми на различни химични елементи и техните абсолютно и относително тегло
Ние вече знаем, че атомите на химичните елементи могат да се различават една от друга по състав и е очевидно, че тя трябва да повлияе на тяхното тегло, тъй като повече в ядрото на общия брой протони и неутрони, така че е по-трудно. Електроните не се отразяват на атомната маса, защото те имат изключително малък в сравнение с масата на неутрони и протони (тр / мен
Тъй като броят на протоните в един атом е винаги равен на броя на електрони, и електроните, когато се разглеждат атомна структура опростени, движещи се около сърцевината на значително отстраняване от него, атомната радиус равен на радиуса на орбитата на най-външния електрона от ядрото. Следователно, трябва да има някаква зависимост от броя на атомната радиуса на орбитата, което до известна степен свързани с количеството на електрони.
Сред химични елементи малките размери са водородни атоми, радиусът на които в нормално състояние е само около 0.0000000000529 m (5.2910 -11 m), или 0529 А, където А - наименование единица дължина, наречен Angstrom и равна на 10 -10 m. Освен това, тъй като тези малки разстояния стойности единици често използват нанометра (нанометра). 1 нанометър = 10 -9 m.
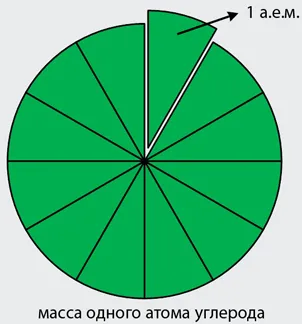
Лесно е да се отгатне, че не само малък размер на атомите, но и теглото им. Например, масата на водород е приблизително 1,674 ∙ 10 -27 кг. Атомна маса, изразена в килограми (д, Mg, и т.н.), той се нарича абсолютна атомно тегло и е определен като ma. Извършване на изчисления с такива малки количества изключително неудобно, така учените са открили следния изход - за измерване на всички маси на други атоми на химични елементи в "водороден атом". По този начин, се оказа, че, например, кислороден атом, тежи около 16 "водородни атоми" въглероден атом - "12 водородни атоми" и т.н. И всичко е добро, но разглезени изотопи - вариации на атоми на един и същ химичен елемент, които се различават между масите, поради различното броя на неутроните в ядрата. Изход може да бъде да използвате някои средна маса на водородния атом, но въпросът се усложнява от факта, че различните изотопи на водорода в природата разпределени неравномерно. Следователно, в крайна сметка, беше решено да се използва като относителна единица маса от масата на водороден атом, и една дванадесета от масата на въглероден атом, тъй като този елемент е почти изцяло въглеродни изотопи само 6 6 протоните и неутроните в ядрото (
99%). Една дванадесета от теглото на изотопа въглеродния атом, означен 1 се смесва атомни масови единици което означава "единица за атомна маса". Една единица за атомна маса е около 1,66 · 10 -27 кг.
Графично представяне на смисъла на една атомна маса единица е показано на фигура 2.
Така стигаме до определянето на новия мандат - относителната атомна маса:
Определение. относителната атомна маса на химичния елемент е съотношението на масата му към абсолютната една дванадесета абсолютната маса на въглерод или теглото на една атомна маса единица.
Относителната атомната маса обозначен с Аг (индекс R означава съкращението на английски думата роднина, който е преведен като "относително"). По този начин, означаващ в общ символ химичен елемент на X, ние получаваме следното определение Формуляр запис представени по-горе:
Относителната атомната маса - е безразмерна защото както на числителя и знаменателя стойности се измерват в същите единици на тегло (кг, г или др.). Съгласно горната формула, например, относителна атомна маса на водород е:
относителна атомна маса на кислород:
Повечето изчислителни задачи, които трябва да се справят химици, стойностите на относителната атомните маси закръглени до целочислени стойности, т.е. по отношение на водород и кислород:
Трябва да се отбележи, че атомното тегло на хлор закръглено до 35.5. Това се дължи на факта, че изотопите на елемента с относителните маси 35 и 36 са по същество равномерно разпределени в природата.