Предмет Colloid Chemistry
Име на колоидна химия идва от гръцката - лепило.
Първият обект на изследването бяха лепило-подобна колоид химически вещества - желатин, пектин, казеин и други макромолекулни съединения.
Модерен колоидна химия значително разширява своите граници и в раздела на физикохимията възниква като самостоятелна наука. И трябва да кажа, модерният колоидна химия - един от малкото науки, чието име не съответства на съдържанието. Той получил това име преди се обособява като самостоятелна наука. В някои страни тя е преименувана на "Повърхностни явления", "Повърхностни явления и разпръсне системи".
Обект на изследване на съвременната колоидна химия са дисперсни системи и макромолекулни съединения. Особено внимание се отделя в колоидни химия повърхностни явления - процеси, протичащи в интерфейса.
В хода на физикохимията разгледахме системата, в която интерфейсът не е играл значителна роля. За повърхностните явления са били усетени, трябва да бъде разработена на интерфейса, което се постига чрез раздробяване една от фазите.
Силно развита интерфазата повърхност са дисперсни системи.
Глава I.Dispersnye система:
Основни характеристики и класификация
1.1 Основни свойства на дисперсни системи
Хетерогенност. Всяка система дисперсия се състои от две или повече фази, т.е. хетерогенна (фиг. 2).
Фрагментни (прекъснат) част на диспергираната фаза на система 1. nazyvayutdispersnoy и несмачкано (непрекъсната) - дисперсия (твърдо вещество) 2 среда.
Между дисперсната фаза и дисперсна среда се формира интерфейс. Необходимо условие за образуването на система дисперсната е неразтворим или ограничена разтворимост на дисперсната фаза и дисперсна среда.
колоидни дисперсии химия проучване, при което частиците на дисперсната фаза имат размер на 10-9- 10-7 М (1-100 пМ). Това колоидни системи.
Дисперсии с еднакви размер частици, наречени монодисперсни. с различни по размер частици - полидисперсно. Реални системи като цяло са полидисперсни.
Голям специфична повърхност. Количественият характеристика на интерфейса на разпръснати системи е специфичен poverhnostSud - С. повърхностна площ на единица маса или обем V m на диспергираната фаза:
Ако частиците на дисперсната фаза имат форма на куб със странична дължина и със същия размер, тогава
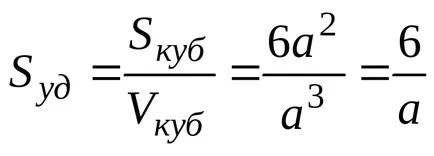
За сферични частици с радиус R
SSF = 4r 2. VSF = 4 / 3r 3.
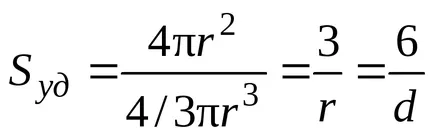
Като цяло, за системи, съдържащи частици свободна форма
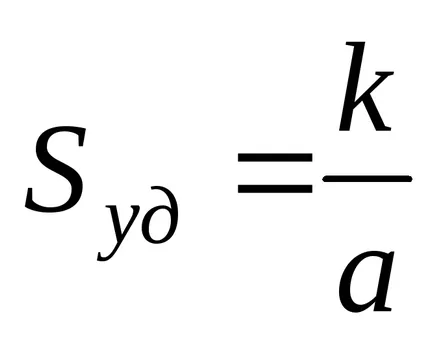
където К - коефициент, зависещ от формата на частиците; и - избран линеен размер на частиците (характерна величина).
Реципрочната стойност на характерната размер, наречен dispersnostyuD:
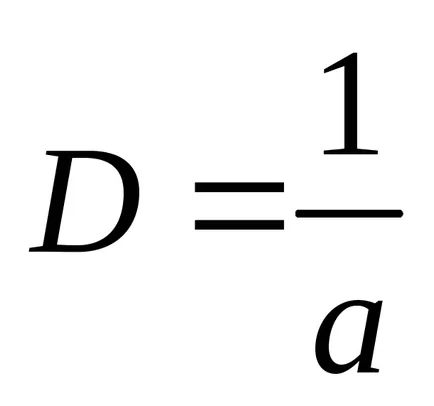
От тези съотношения е очевидно, че по-малките характеристика на размера на диспергирана фаза на частиците, по-голяма специфична повърхност и диспергиране. Ние показваме това, като един пример.
Да разгледаме кубична форма на частиците.
По този начин, при смачкване на частиците значително увеличава специфичната повърхност на диспергираната фаза.
Най некомпенсиран повърхност енергия. Разликата между съседни фази състав и естеството на междумолекулни взаимодействия в тези фази предизвиква поява некомпенсиран повърхностна енергия. Тъй като фрагментация и високо повърхностно интерфейс дисперсии се характеризират със значителен излишък повърхностна енергия.
Помислете за системата за течен газ.
За частици в насипно състояние течна фаза, получената сила на междумолекулна взаимодействието е 0, тъй като околностите от всички посоки еднакво. Force вектори, насочени в различни посоки, но са равни по сила. Оказва симетрична силово поле.
Частиците разположени върху повърхността взаимодействат както с еднородни частици и с части-
Tsami друг вид. Разбира се, че привличането от привличането на молекулите на газа е по-слаба от течни молекули. В резултат на асиметрията на силовото поле на получената сила насочена навътре плътни фази (течни). Този ефект често се нарича вътрешно налягане. Колкото по-силна от междумолекулни взаимодействия в различни съседни фази, толкова по вътрешното налягане. За течности в интерфейс с вътрешно налягане на въздуха е много голяма, например, е 14,800 водни среди. Следователно, течният капчица с увеличаване на външен натиск не променят неговата плътност, т.е. те са несвиваеми.
За всички частици на повърхностния слой нереализирана капацитет за взаимодействие с двете страни на една от фазите (в този случай, газ) характеризира Gpov свободен повърхностна енергия. и който определя хода на различни повърхностни процеси.
Очевидно е, че общата сума на енергия на фазата на повърхност се определя от големината на повърхността S. Следователно характеристики на интерфейса отделяне на тази фаза от друга, въведени концепцията на повърхностното напрежение.
Повърхностно напрежение - това физикохимични количество характеризиращи операцията термодинамично обратим процес единица нова повърхност при постоянна температура, налягане и състав на флуида.
За образуване на междуфазова повърхност, е необходимо да се прехвърлят някои от молекулите на течния обем на повърхността. За това е необходимо за извършване на работа срещу вътрешното налягане тенденция да се направи повърхностни молекули фаза вътре слой.
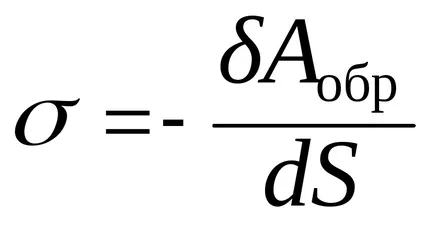
където Aobr - обратим термодинамичен работа; тъй като работата се извършва на системата, тя е отрицателна.
където G - свободната енергия на Гибс,
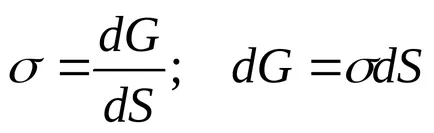
По този начин, повърхностното напрежение - е специфичната повърхност без енергия, т.е. повърхностно свободна енергия за единица повърхностна площ.
Очевидно е, че колкото по-малка от повърхностното напрежение, толкова по-лесно образуване на нова повърхност. Например, образуването на пяна, придружено от увеличаване на междуфазовата повърхност е значително по-лек в детергентен разтвор, отколкото в чиста вода с високо повърхностно напрежение.
Единица за измерване на повърхностното напрежение - J / т2 = N / m.
Повърхностно напрежение характеризира разликите в интензивността на междумолекулни взаимодействия на съседни фази. Колкото по-голяма разликата, толкова повече .
Повърхностно напрежение позволява повърхността да издържат теглото на паяк вода и паяк да се ходи по повърхността. (За да се даде пример с игла).
Повърхностното напрежение на границата от две кондензирани фази наречен интерфаза. Той се образува на граничната повърхност на две взаимно неразтворими течности, твърдо вещество-течност и две твърди тела и съответно обозначени zh-вата t-Е. t-тон.
Повърхностно напрежение намалява с повишаване на температурата. Това се дължи на увеличаване на налягането на парите и намаляване на междумолекулни взаимодействия некомпенсиран. Поради това е необходимо да се посочи температурата в стойностите на оценка .
При 293 К повърхностното напрежение на водата е 72.75 MJ / m 2. слънчогледово масло - 33, сурово мляко - 45-60, както и сухи вина - 46-52 MJ / м 2 по-долу вода.
Според принципа на минималната свободна енергия, всеки етап ще се стреми да намали неговата повърхност енергия. Следователно, системата за течност е под формата на минимална повърхност на дадена фаза обем - сфера.
Ефект на повърхност кривина. Н кривина, определена от производно на повърхността по обем:
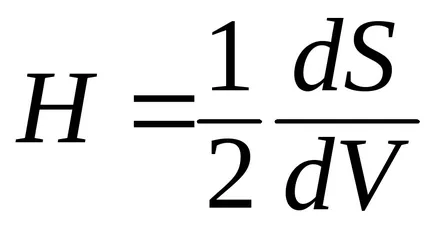
Кривината може да бъде положителна или отрицателна. Ако центърът на кръга е разположен в тялото, което се определя от кривата на повърхността, е положителен; ако в центъра на кръга, вън от тялото, кривината е отрицателна. Кривината на плоска повърхност е равна на нула, и радиусът на кривината - безкрайност. С нарастване на кривина радиус на кривината намалява.
Кривината на повърхността засяга редица физични и химични свойства. Така налягането на наситените пари над вдлъбната повърхност е по-малка от над равнина, т.е. над вдлъбната повърхност пара се кондензира при по-ниско налягане.