Получаване на карбоксилни киселини
Етап 1 - формирането на алдехиди.
CH 3 СН2ОН
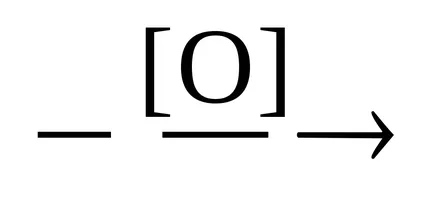
Етап 2 - от желания продукт.
СН3 СНО
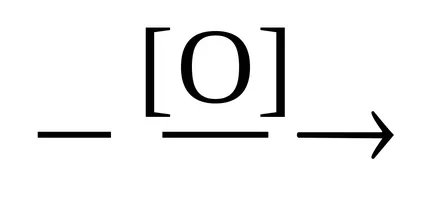
2. Хидролизата на нитрили.
3. oxosynthesis на ненаситени въглеводороди.
SN3 СН = СН2 + СО + Н2 О
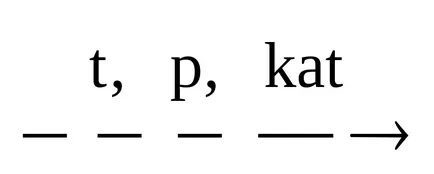
В процеса на оксо често молекула Получените продукти съдържат още един въглероден атом от изходните материали.
Химичните свойства на карбоксилна киселина
1. Реакциите с водород uchastiiem карбоксилна група.
1.1. Някои киселина значително дисоциират с отстраняване на Н + катион.
Както е отбелязано по-рано, за карбоксилни киселини се характеризират с относително висока константа на дисоциация. Мравчена киселина, имаме:

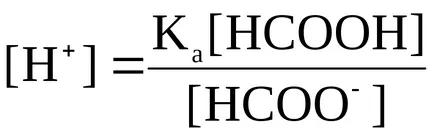
NGS formiat йон; СН3 COO atsetat йон.
1.2. Взаимодействие с метали
1.3. Взаимодействие с основи.
RCOOH + NaOH RCOONa + Н 2О
1.4. Взаимодействие с основни оксиди.
1.5. Взаимодействието с солите на слабите (подобни в сила) киселини.
2. Реакциите, включващи карбоксилната група.
2.1. Реакция с фосфорни халогениди.
2.2. Реакция с амоняк. При смесване на киселина и амоняк първоначално образува амониева сол, която след това се подлага на суха дестилация:
4. окисление.
Свойствата на отделните представители на хомоложни серии
НСООН мравчена киселина, съдържаща се в иглата, коприва, в секрети мравки. Това е - безцветна течност с остър неприятна миризма. Той причинява изгаряния на кожата, се смесва с вода, етери, алкохоли в всяка връзка. г = 1,21 г / см 3.
Оцетна (етанолова, metilkarbonovaya) киселина СН3 СООН. При обикновени температури - безцветна течност с остра миризма. Смесва се с вода, етанол, диетилов и диметилов етер, бензен, при всяка връзка. Неразтворимо vCS2. Оцет същност - 70-80% разтвор на CH 3 COOH. Оцет хранителен - 5% разтвор. Т.т 17S, т.к. = 118,1S, г = 1,05 г / см 3 се използва за боядисване, в кожарската промишленост, хранителната промишленост, за получаване на естери (ацетати).
Оцетен анхидрид. Тт = 73,1S, т.к. = 139,5S. Той има остър мирис, разтворим в бензол, диметилов етер, хлороформ. Дипол moment2,82D, H2 O1,84D. В голям мащаб се използва за получаване на фармацевтични целулозен ацетат.
задачи, свързани с
Задача 1. Изчислява се масовият процент на сол в разтвор на моноосновен карбоксилна киселина с ограничаване първоначалното си тегло 200 г и масова част на водород в киселина 8.1%, когато солта се образува чрез абсорбция на амонячен разтвор 5.6 L (нормални условия).
Уравнението на реакцията.
Установяване киселина молекулна формула.
;
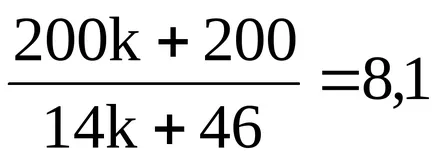
200k + 200 = 113,4k + 372,6;
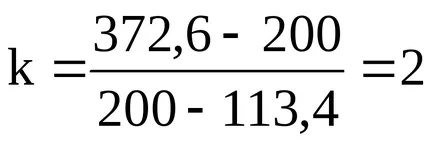
Рафинирано уравнение реакция има формата:
от което следва:
m2 (разтвор) = 200 + 4.25 = 204.25 грама
.
Проблем 2. При взаимодействие на смес от монокарбоксилни киселини с 50 г сребърен окис с излишък от 16,8 литра газ се разпределя (нормални условия). След това полученият разтвор се пропуска през излишък амоняк. Намери маса, образувана сол, ако присъстват в кислородния маса фракция на еквимоларна смес от киселини е 60,4%.
Уравнението взаимодействие на изходните материали с сребърен оксид, като се вземе предвид, че границата на монокарбоксилни киселини с реагира само мравчена киселина.
С помощта на уравнението на реакция (1) намираме тегло мравчена киселина:
п (НСООН) = N (СО2); m (НСООН) = N (НСООН) M (НСООН) =
Намираме неизвестен молекулна формула на карбоксилна киселина.
;
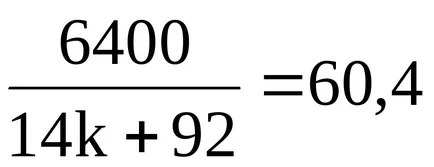
6400 = 845,6k + 5556,8;
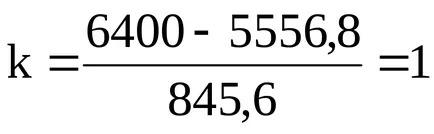
Молекулна формула киселина СН3 СООН.
Взаимодействието на мравчена киселина с сребърен окис в разтвор може само оцетна киселина, която чрез взаимодействие с излишък от амоняк за да се образува сол, съгласно уравнението на реакция:
m (CH3 COOH) = М (смес) -m (НСООН) = 50 - 34.5 = 15,5 грама
От уравнението на реакция (3), имаме: