Получаване на халогени - studopediya
Флуорът се получава чрез електролиза на безводен (като флуор реагира с вода) HF в стопен калиев бифлуорид KHF2:
Хлорът окисляване се получава в лабораторията на концентрирана солна киселина:
В промишлени леност - електролиза на натриев хлорид:
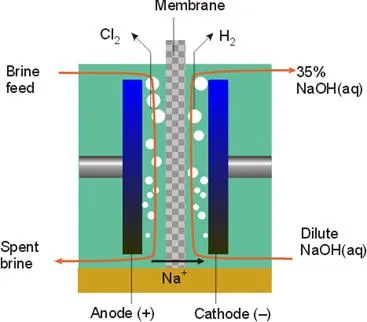
Има 2 начина на електролиза - и диафрагма мембрана.
Мембрана метод на производство на хлор е най-енергийно ефективни, но комплекс в организацията и работата.
В съвременните Електролизери катод и анод пространство са разделени от полимерен анион обменна мембрана. Мембраната позволява катиони Na + преминават от анодното отделение в катода. Лятно електронеутралност катиони подкрепя от двете страни на електролизера, защото по време на електролизата отрицателните йони се отстраняват от анода (преобразуване 2Cl - в Cl2) и се натрупват в катода (образуване на ОН -). Преместването ОН - в обратна посока може да поддържа електрически неутралност, но йон ОН - ще реагира с Cl2 и неутрализиран цялата резултат.
Отделението за анод се подава поток от разтвор на сол и катод - дейонизирана вода. От катодното пространство е поток обеднен анолита съдържаща същите примес gipohlorit- и хлорат йони и е хлоро, и анода на - алкален и водород, съдържащ по същество не примеси и концентрация близо до продукта, което намалява разходите за енергия за изпаряване и пречистване.
Подаваният разтвор на сол (както пресни и циркулиращи) и максимално предварително почиства вода от примеси. Това цялостно почистване се определя от високата цена на полимерните катионобменни мембрани и тяхното уязвимостта на примеси в изходния разтвор.
В промишлеността, бром и йод се получава чрез хлориране на морската вода (водни и някои солени езера)
лаборатория (рядко), получен чрез окисляване на хлориди и бромиди:
или хлоро чрез заместване на соли:
Химични свойства халогена
Флуорът е химически изключително активен, е най-силен окислител. Атмосферата на флуор дори изгори и водно стъкло, азбест и тухли:
Един от продуктите на горенето е кислород, т.е. флуор е силен окислител от кислород.
Флуоро окислява на "благородни газове":
Хлорът е също силен окислител, намаляване свойства показва само с флуор. Може непропорционално:
Взаимодействие с халогенни прости вещества:
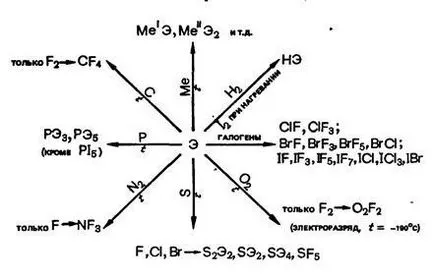
Взаимодействие с основни реагенти халоген:
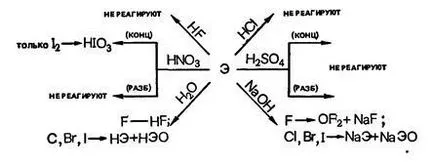
Бром и хлор са разтворими във вода и частично взаимодействие с него, за да образуват така наречената "белина вода" и "бром вода."
Йодът е практически неразтворим във вода и не е способен да окисли дори при нагряване; Поради тази причина, няма "йод вода."
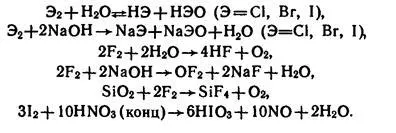
Халогениди Hhal - газове (с изключение на HF), добре разтворими във вода.
Общи характеристики на халогеноводороди:
Сред сила HF-HCl-НВг-HI Н-E връзка намалява киселина повишава здравината, намаляване на мощността се увеличава.
Сред HF-HCl-НВг-HI диполен момент намалява, но увеличава поляризуемост на молекулите, така топене и кипене температури увеличение.
Силно полярни молекула HF () образува асоциирани поради водородни връзки. Следователно HF за разлика от друг водороден халид е течност. Дори в HF газообразно състояние се състои от полимери (HF) п. п = 2-6.
Поради силното междумолекулни взаимодействия HF молекулата дисоциира съгласно схемата:
Н-F # 8729, # 8729, # 8729, Н-F # 8729, # 8729, # 8729; Н-F ↔ [H-F-Н] + + [F-Н-F] -
или Н-F # 8729, # 8729, # 8729, Н-F # 8729, # 8729, # 8729; Н-F ↔
Методи за получаване galogenovodorov:
HF се получава от флуорит с концентрирана сярна киселина:
Солна киселина в индустрията се получава чрез синтез от прости вещества:
В лабораторията, солна киселина се получава от хлориди:
НВг се получат чрез взаимодействие:
HI се получава чрез хидролизиране фосфор йодид PI3 и реакцията:
В реакцията на HF с алкали образува дифлуорид:
Флуороводород и флуороводородна киселина и унищожи кварц стъкло:
Течен флуороводород е добър разтворител разтваря вода, флуориди, сулфати и нитрати S-I групови елементи и малко по-лоши S-II елементи група.
- силни киселини (с изключение на HF, е силно само в чиста форма)
дисоциация степен # 945; в 0.1 М разтвори киселина при 18 ° С: