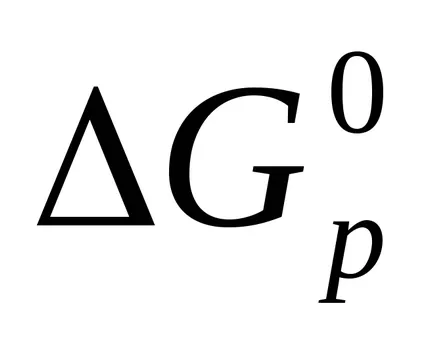Общи закономерности на химични процеси, енергия (термодинамиката), химически процеси
На вътрешната енергия на системата. Топлината. Rabota.Izakon термодинамиката. Enthalpy. Енталпия на образуване на материал. Енталпията реакция. Entropiya.IIzakon термодинамиката. Промяната на ентропията в химически процеси. Gibbs енергия на образуване на материал. Gibbs енергия на реакцията. Ориентация на химическите процеси.
Термодинамика изучава законите на преход от различни видове енергия. В химични реакции, тези промени са придружени от абсорбцията или освобождаването на енергия под формата на топлина. Реакциите са придружени от поглъщане на топлина, nazyvayutsyaendotermicheskimi и реакцията придружено с топлинна енергия -ekzotermicheskimi.
Всяка система е в процес на постоянни физически условия има определен резерв от енергия, наречена на вътрешната енергия на системата / U /. Състои се от енергията на движение и позициониране на молекули, атома, ядра и електрони, и енергията, причинени от привличане и отблъскване между тях сили на. Въпреки това, на вътрешната енергия не включва кинетичната енергия на движение на системата като цяло и потенциалната енергия на състоянието на системата в пространството.
Когато всеки процес, спазва закона за запазване на енергията. Топлината (р) се сумират до системата се консумира във вътрешната промяната на енергия (ΔU) и точкуване работа (А).
Q = δ ф + на
При постоянно налягане (че повечето химични процеси) работят - работа за промяна на обема, т.е. А = р · ΔV, където р - налягането в системата, промяна обем система aΔV- (Vkon -Vnach.).
В този случай, QP = ΔU + р · ΔV
или QP = (Ukon. -Unach.) + р (Vkon. -Vnach).
Q р = (Ukon pVkon + ..) - (+ Unach Vnach стр.).
сума U + pVoboznachayut cherezHi nazyvayutentalpiey на. Следователно топлината от реакцията (топлинен ефект) с постоянно налягане равно на промяната в енталпията на системата:
Enthalpy - (? H) термодинамична функция на състоянието на системата, така че абсолютната стойност на енталпията на една система не може да се определи, като се изчислява само промяната на енталпията .В termohimicheskihraschotah енталпия винаги се изразява cherezΔN. За сравнение енталпия (топлинен ефект) различни процеси тези стойности водят до еднакви условия и таблици predstavlenystandartnye енталпии (
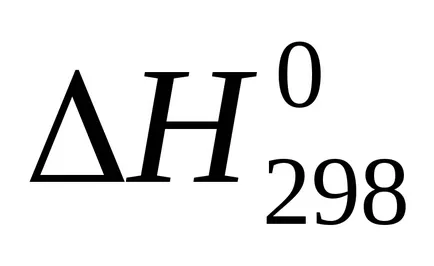
температура 298 К (25 0 ° С)
101.3 кРа (1 атм).
Енталпия на образуване на прости вещества приема да бъде нула, ако съвкупните си страни и модификации са стабилни при стандартни условия.
Например:
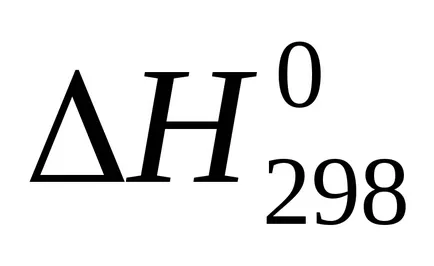
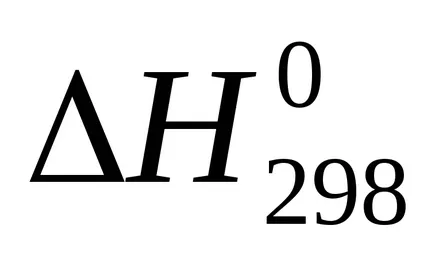
Енталпия на образуване на съединение е енталпията на образуване на реакцията на един мол от веществото от прости вещества.
Пример 1: енталпия на образуване на вода:
2Н2 (ж) + 2 (г) = 2Н2 О (ж)
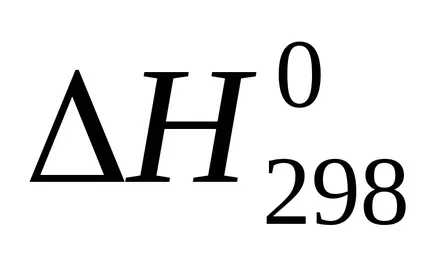
Това означава, че енталпията на образуване на вода в газовата фаза е - 484kDzh. 2mol = -242 кДж / мол
Enthalpy се изчислява от закона разследване Хес: "енталпия на химичната реакция е сумата от енталпиите на образуване на продуктите на реакцията минус сумата от енталпиите на формиране на изходните материали при отчитане на стехиометрични коефициенти."
ΔNr = Σ (п ∙ АН) Cont. - Σ (п ∙ АН) Код ,.
при което броят на моловете n-.
Пример 2. Изчисляване на топлината от реакцията. Посочете ендо- или екзотермична реакция при стандартни условия.
Мола, n4 5 4 6
енталпия
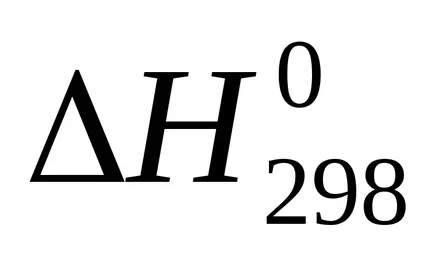
? Реакция H 0 = [4 (+91) +6 (-242)] - [4 (-46) + 5 · 0] = -904kDzh.
Тъй Δ Н<О, данный процесс сопровождается выделением тепла, т.е. является экзотермическим.
Стойностите на термодинамичните функции при стандартни условия
Термодинамика установява посоката на потока на спонтанно процеси в тези условия. При създаване на спонтанен характер на реакцията беше установено, че спонтанно екзотермична реакция придружено от (? Н<Ο). Однако связь между снижением энтальпии системы и самопроизвольностью протекания процесса является недостаточным фактором.
Друг фактор при определяне на спонтанен процес е термодинамично функция, наречена ентропия (S). Ентропията е мярка за ред в състоянието на системата. През реакционната ентропията на системата се променя химически. Тази промяна nazyvaetsyaentropiey реакция.
Ентропията реакция също се изчислява по разследването на Хес право.
ΔSp = Σ (п · S) prod.- Σ (п ∙ S) лит.
Пример 3. изчислява промяната ентропията на системата чрез реакция при стандартни условия.
Бенките, n1 2 Януари
ентропия
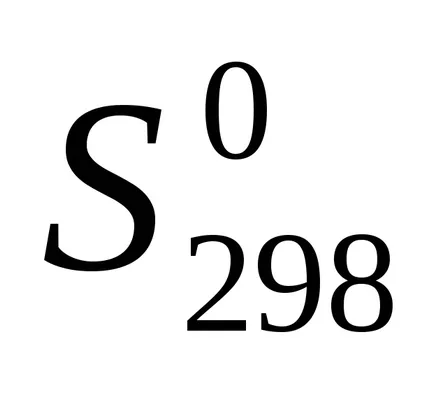
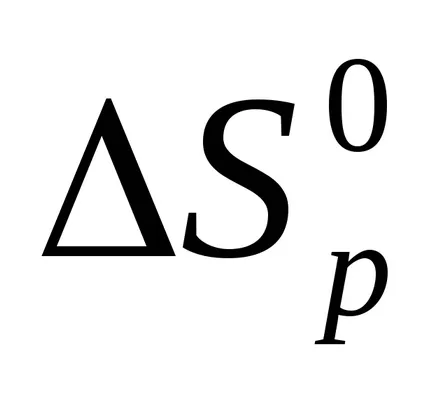
Всички процеси, които се случват с низходящ ред на системата, придружено от увеличаване на ентропията и обратно. Спонтанно текат процеси, протичащи с увеличение на ентропията. За процеси, протичащи в изобарни - изотермични условия (р = конст, Т = конст) движещата сила на спонтанен процес е тенденцията на системата да се премине към състояние с ниска енталпия (енталпия фактор) на, или с увеличаване на ентропията (ентропията фактор). Стабилна състояние на системата съответства на равенство на тези фактори.
Термодинамични функция, която показва как системата в това състояние се е отклонил от равновесието, наречен Гибс енергия (G).
Ако: ΔG <0. процесс может протекать самопроизвольно в прямом направлении;
ΔG = 0. процес в състояние на равновесие;
ΔG> 0. процес спонтанно в посока напред
не може да се осъществи.
От ΔG отношението = Н - T ∙ ΔS се вижда, че процеси могат да протичат спонтанно?:
екзотермична (? Н <0). Для которых: ∆S> 0.
ендотермичен (? H> 0). За които: ΔS> 0. но / T · ΔS > / H /,t.e?. при високи температури.
Реакция Гибс енергия се изчислява също така и за разследването на Хес право.
Пример 4. Посочва възможността за спонтанна реакция при стандартни условия.
Броят на мола, п 1 1 2
Гибс енергия,
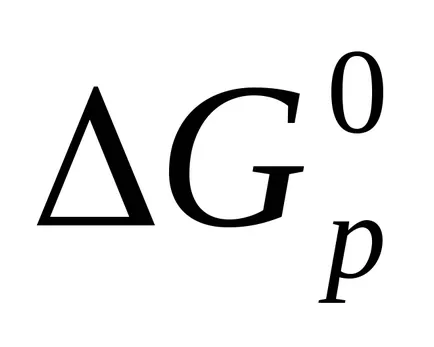
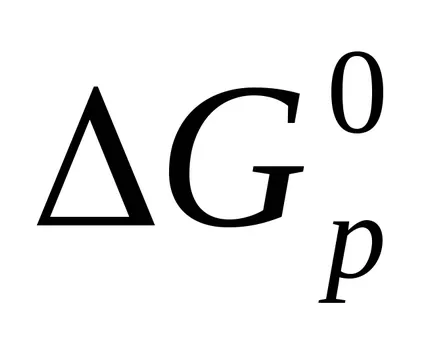
защото