Общи физични и химични свойства на метали, подготовка за DH и изпита по химия
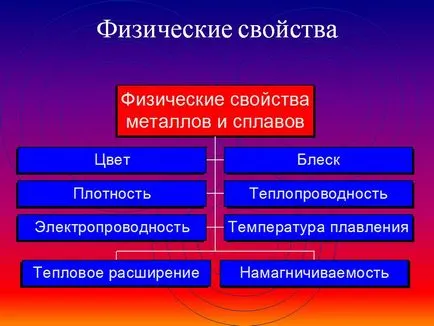
Общи физични свойства на металите
Поради наличието на свободни електрони ( "електрон газ") в кристалната решетка на всички метали показва следната характеристика общо:
1) пластичност - способност да променя формата лесно изготвен в тел, навити на тънки листове.
2) Метален блясък и непрозрачност. Това се дължи на взаимодействието на свободни електрони и лек инцидент на метала.
3) електрическата проводимост. Той обясни, посока свободно движение на електрони от отрицателния полюс до положителен под влиянието на една малка разлика в потенциалите. При нагряване, електрическата проводимост намалява поради амплифицира с увеличаване на температурни колебания атоми и йони в кристалната решетка, което усложнява посока движението "електрон газ".
4) топлопроводимост. Поради високата мобилност свободни електрони, при което бързо изравняване на температурата на металната маса. Най-високата топлопроводимост - бисмут и живак.
5) твърдост. Най-трудното - хром (кристал); най-меките - алкалните метали - калий, натрий, рубидий и цезий - нарязани с нож.
6) Плътност. Това е по-малка от долната атомно тегло и по-голяма метал атомен радиус. Най-лесният - литий (ρ = 0,53 г / см3); най-трудната - осмиев (ρ = 22,6 г / см3). Метали с плътност по-малко от 5 г / см3, се считат за "леки метали".
7) топене и кипи температури. Най-топим метал - живак (т.т. = -39 ° С), най-огнеупорен метал - (. T ° PL = 3390 ° С) волфрам. Метали с точка на топене Т °. над 1000 ° С се счита за огнеупорна, нисш - ниска точка на топене.
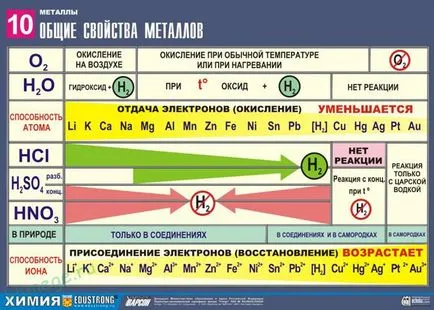
Общите химични свойства на метали
Силни редуктори: Me 0 - NE → Me п +
Няколко стрес характеризира относителната активност на метали в редокс реакции във водни разтвори.
1. Реакциите на метали с неметали
1) кислород:
2mg + О2 → 2MgO
2) серен:
Hg + S → HGS
6) с водород (реагират само на алкални и алкалоземни метали):
2Li + Н2 → 2LiH
2. Реакциите на метали с киселини
1) Метали, стоящи в електрохимичната напрежение серията H-киселинни neokisliteli намалени до водород:
2) киселина-оксиданти:
Чрез взаимодействие на всяка концентрация на азотна киселина и концентрирана сярна метал водород никога разпределени!

3. Взаимодействие на метали с вода
1) активност (алкални и алкалоземни метали) образува разтворим основа (алкални) и водороден:
2) средно метали активност окислени от вода при нагряване до оксид:
3) неактивна (Au, Ag, Pt) - не реагират.
4. Почистете повече активни метали по-малко активни метали от разтвори на техните соли:
В промишлеността, използването често не е чисти метали и смеси от тях - сплави. където полезните свойства на метала се допълват от други полезни свойства. Например, мед е с ниска твърдост и е от голяма полза за производството на машинни части, сплави от мед с цинк (месинг) вече са достатъчно твърди и са широко използвани в машиностроенето. Алуминиева има висока пластичност и достатъчно лекота (ниска плътност), но твърде мека. На тази основа се подготвят сплав с магнезий, мед и манган - дуралуминиум (дуралуминиум), който е без загуба на полезните свойства на алуминиев оксид, твърдостта става високо и става полезни в производството на самолети. сплави от желязо с въглероден (и други метални добавки) - е широко известни желязо и стомана.
Метали в свободна форма са редуциращи агенти. Въпреки това, реактивността на някои метали е ниска поради факта, че те са покрити с филм повърхност оксид. в различна степен на устойчивост на действието на химикали, като например вода, киселина и алкални разтвори.
Например, олово винаги е покрита с филм оксид, прехода към разтвора изисква не само въздействието на реагент (например, разредена азотна киселина), но също така и нагряване. филм оксид върху алуминиев предотвратява неговото взаимодействие с вода, но е разрушен от действието на киселини и основи. Инертни оксид филм (ръжда), оформен върху повърхността на желязо в влажен въздух не предотврати по-нататъшното окисляване на желязо.
Под действието на силни киселини образува стабилен оксид филм на метали. Това явление се нарича пасивиране. По този начин, в концентрирана сярна киселина пасивирана (и след това не реагира с киселината), метали като Be, Bi, Co, Fe, Mg и Nb и концентрирана азотна киселина - метална А1, Be, Bi, Co, Cr, Fe , Nb, Ni, Pb, Th и U.
Чрез взаимодействие с окислители в кисели разтвори постъпления повечето метали в катионите, таксата се определя от стабилна на окисление на елемента в (Na +. Са2 +, А1 3+, Fe2 + и Fe3 +)
Редуктивно активност на метали в кисел разтвор се прехвърля в близост напрежения. Повечето метали превежда към разтвор на солна киселина и разредена сярна киселина, но Cu, Ag и Hg - само сярна (концентрирана) и азотна киселина, и Pt, Au и - "царска вода".
корозия на метала
Нежелани химично свойство е тяхната корозия метали, т. Е. активен влошаване (окисляване) при контакт с вода и се под влиянието на разтворен кислород (корозия кислород). Например, широко известен желязо корозионни продукти във водата, в резултат на ръжда и се разпада на прах продукт.
Корозия на метални възниква като във вода, поради наличието на разтворени CO2 и SO2 газове; Това създава кисела среда, и катиони Н + са разселени активни метали за образуване водород Н2 (водород корозия).
Това е така, защото на тази повърхност ръжда кутии консерви (желязо, покрит с калай), когато се съхраняват във влажна атмосфера и небрежно боравене (желязото строшава надолу бързо след появата на още една малка драскотина, позволяващи контакт желязо с влага). За разлика от повърхността на поцинкована стомана ръжди кофи дълго, защото дори и ако има драскотини корозира желязо и цинк (по-активен метал от желязо).
устойчивост на корозия за даден метал се увеличава с неговата по-активна метално покритие или ги сливане; така, покритието на желязо хром сплав или желязо хром производство премахва корозия желязо. Chrome желязо и стомана, съдържаща хром (неръждаема стомана) имат висока устойчивост на корозия.