обменни реакции йонни 1
5. РАБОТЕН LABORATORY електролитна дисоциация
Кратка теоретична информация
[K m +] п · [A п -] m = конст = PR.
От концепцията за условия PR потоци за формирането на валежите
([К + m] п · [A п -] М> OL)
разтваряне и утаяване
([К + m] п · [A п -] М <ПР).
Продуктът от разтворимостта на някои слабо разтворими електролити при 25 ° С е показан в таблица. 6 приложения.
Следните правила за писане на йонни реакции:
• malodissotsiiruyuschih съединения с формула (утаяване газове elktrolitov слаби, комплексни йони) се записва в молекулна форма;
• и дисоцииране вещества с формула (силни електролити) се записва в йонна форма;
• метатеза написан на молекулна, йон молекулна и йонна форма.
Разглеждане на получаването на железен хидроксид (III), в резултат от взаимодействието на водни разтвори на железен нитрат (III) и натриев хидроксид. Молекулно реакция уравнение:
Fe (NO 3) 3 + 3NaOH = Fe (ОН) 3 ↓ 3 NaNO 3
Пълното-йонна реакция уравнение:
Fe3 + + 3NO - 3 + 3Na + + OH - = Fe (ОН) 3 ↓ + 3Na + + 3NO - 3
Силни електролити - железен нитрат (III) и разтвор на натриев хидроксид присъстват като йони. Желязо хидроксид (III) - слаб електролит и железни йони и хидроксилни йони в разтвора почти не се образува. Sledovatel-
но взаимодействат само Fe3 + йони и ОН -. Премахването на йони Na + и NO - 3, от двете страни на уравнението, ние получаваме намалена йонен уравнение:
Fe3 + + 3OH - = Fe (ОН) 3 ↓
Химия. Lab. практическа работа
5. РАБОТЕН LABORATORY електролитна дисоциация
Кратка теоретична информация
Само взаимодействието на тези йони отразява същността на процеса, т.е.. Е. Определя посоката на реакцията, така че трябва да използвате кратък запис йон.
Опит 1 Zavisimostelektroprovodnostiotstepenidissotsiatsiielektrolitov
Проводимостта на решения до голяма степен зависи от степента на дисоциация на електролита. В същата концентрация, по-висока е степента на дисоциация на електролита, по-голяма от стойността на неговата проводимост.
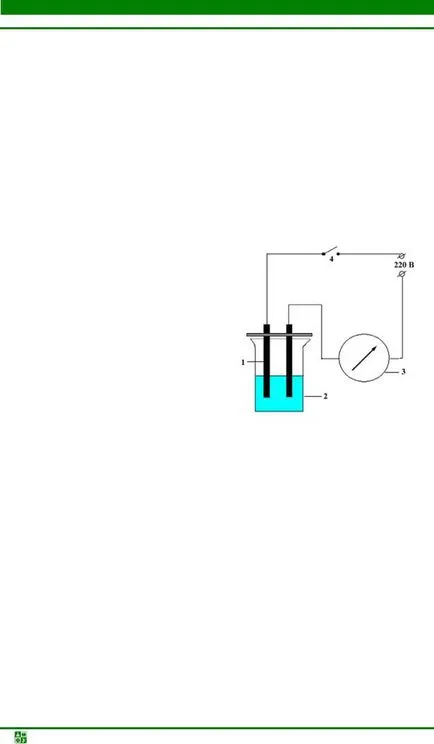
Фиг. 5.4. Схема определяне на електропроводимостта на разтвори: 1 - графитни електроди; 2 - стъклото на разтвора за изпитване; 3 - волтметър; 4 - Ключ
За проучване на електропроводимостта на разтвори, използвани инструмент схематична диаграма е показана на Фиг. 5.4. Преди експеримента устройството включва мрежа. 2 Стъкло 50 мл всеки път, напълнена с разтвора до 1/2 от обема си, тази област на електродите, спуснати в течността във всички експерименти са същите. Електроди 1 след това се потапят в разтвора и само след затваряне на веригата с ключа 4.
Определяне на проводимостта на следните разтвори: дестилирана вода, захари, оцетна киселина, амониев хидроксид, амониев ацетат и натриев хлорид. Промива електродите с дестилирана вода след всяко изпитване разтвор. Изходни разтвори проводимост се оценява чрез огъването на волтметър 3, толкова по-голяма деформация, толкова по-голяма проводимост.
Въз основа на тези резултати, поставете електролитите в реда на увеличаване на електропроводимостта. Напиши дисоциацнонни уравнения. За слаби електролити, дисоциация рекорд.
Химия. Lab. практическа работа

5. РАБОТЕН LABORATORY електролитна дисоциация
Обяснява увеличение проводимост разтвор на амониев ацетат, получен чрез източване разтвори на оцетна киселина и амониев хидроксид, в сравнение с електропроводимостта на първоначалните решения.
Експеримент 2 Vliyanierazbavleniyarastvora
Тестване на проводимостта на концентрирана (80%) и се разрежда (2N). Оцетна киселина. Наблюдавайте увеличаване отклонение стрелки волтметър амплитуда в случая с разредена киселина. Заключения за посоката на преместване на разтвор равновесие дисоциация разреждане.
Експериментирайте 3 Vliyanieodnoimennogoiona
В експеримента се използва индикатор - (. Виж таблица 5.1) фенолфталеин и метил оранжево оцветяване, което варира в зависимост от формата, в която (киселинна или основна) са те.
а) две тръби изсипва 5 - 7 капки 0.1N. разтвор на оцетна киселина и една капка метил оранжев индикатор. Light оранжев цвят променено на розово. В една от тръбите, се добавят няколко кристали от натриев ацетат и се разбърква. Наблюдавайте промяната на цвета на индикатора от розово до оранжево.
б) две тръби изсипва 5 - 7 капки 0.1N. разтвор на амоняк и една капка индикатор фенолфталеин. Разтворът се оцветява в червено. В една от тръбите, се добавят няколко кристали на амониев хлорид. Гледайте избелване решение.
Използване на експресията на дисоциационните константи на оцетна киселина и амониев хидроксид (К г (CH 3 COOH) = 1,86 · 10 -5 К г (NH 4 ОН) = 1,77 · 10 -5),
обясни причината за изместване на равновесието.
Опитът 4 Opredelenienapravleniyaprotekaniya
В епруветка с 5 - 7 капки разтвор на натриев ацетат, се добавят 3-4 капки сярна киселина (1: 1) и се смесва внимателно се загрява епруветка в разтвори на водна баня. Определяне на образуването на оцетна киселина
Химия. Lab. практическа работа

5. РАБОТЕН LABORATORY електролитна дисоциация
характерен мирис. Във втория пълнене тръба 5 - 7 капки разтвор на амониев хлорид и 3-4 капки от 4N. алкален разтвор, разтворът се нагрява. Изолиране на амоняк от епруветките се определя от специфична миризма.
Запишете реакционната уравнението в молекулното и йонна форма. Направи заключение относно посоката на потока на изследваните реакции, които се използват
Използване на дисоциационната константа на оцетна киселина и амониев хидроксид (вж. Прил. Таблица. 8).
Опитът 5 Poluchenieirastvorenieosadkovmalorastvorimyhelektrolitov
Умерено разтворим утаяване и се разтваря чрез промяна на концентрацията на йоните образуващи съединението съгласно стойност CR на тези съединения.
Двете тръби изсипва 1-2 мл разтвор на 0.1 М СаСЬ 2, калциев хлорид и се добавят 1.2 мл 0.1 М Na 2 СО разтвор 3. натриев карбонат в епруветка се добавя малко солна киселина, а другата - оцетна киселина. Утайката се разтваря в една тръба, в която е добавен солна киселина. Обяснете на резултатите от експеримента, като се използват стойностите на константата на дисоциация на киселини и PR CaCO 3:
К г (CH 3 COOH) = 1,86 · 10 -5; К г (I) (Н 2СО 3) = 4.3 х 10 ~ 7;
К г (II) (Н 2СО 3) = 5,6 · 10 -11; CR = 3.8 х 10 -9.
Напиши уравнения на реакциите и разтваряне на утайката.
ПРИМЕР Пример 1. Реакцията за образуване на слаб електролит:
HCl + КОН = Н 2О + KCl
R е т н д запише пълната йонен уравнението .:
Н + + Cl - + K + + OH - = Н 2О + K + + Cl -
Реакцията произвежда слаб електролит - вода; премахване на натриеви и хлорни йони, йонни получи кратко уравнение:
Пример 2 Пример за образуване на реакционна газова:
5. РАБОТЕН LABORATORY електролитна дисоциация
Примери за разтвори на типичните проблеми
Na 2СО 3 + H 2 SO 4 = Na 2 SO 4 + Н 2СО 3
. R е т н е В резултат на реакцията се образува слаб електролит Н 2СО 3. разпада в СО 2 и Н 2О:
2Na + + СО 2 Март - + 2Н + + 2Cl - = 2Na + + 2Cl - + Н 2О + СО 2 ↑
CO 03 Февруари - + 2Н + = Н 2О + СО 2 ↑
ПРИМЕР Пример 3. Реакция утайка разтваряне:
CaCO 3 ↓ + 2HCl = CaCl 2 + 2Н 2О
. R е т н д силни електролити включват солна киселина, калциев хлорид, и слабите - калциев карбонат и вода, където водата - слаб електролит.
Пълното-йонна уравнение е
CaCO 3 ↓ + 2Н + + 2Cl - = Са2 + + 2Cl - + 2Н 2О
С изключение на хлорните йони, йонни получи кратко уравнение:
CaCO 3 ↓ + 2Н + = Са2 + + 2Н 2О
1. Каква е основната причина за дисоциация? Това зависи от способността на електролита за дисоциацията на вида на химична връзка?
2. Какви вещества се наричат електролити? На каква база са разделени на силните и слаби електролити?
3. Напишете уравнението на електролитна дисоциация от най-известните силни киселини и основи във вода.
4. Какво е константата на дисоциация? Как да се различава от степента на дисоциация и това, което зависи от?
5. При какви условия метаболитните реакции се провеждат до края? Дайте примери.
6. Какво се нарича разтворимост продукт? Какви са условията за образуване и прекратяване на дъжда?
7. Писане всички възможни уравнения електролитна дисоциация на въглеродна киселина и сярна хидроксид, железен (III) и се изразява в общата форма на техните дисоциационните константи.
8. Направи йонен и молекулно уравнение на следните реакции:
а) CH 3 COOH + NaOH = ... B) Zn (OH) 2 + HNO 3 = ...
Химия. Lab. практическа работа