Най-възбудено състояние на атома

Начало | За нас | обратна връзка
Най-възбудено състояние на атома - енергично нестабилно състояние, в което атома отива да даде енергия отвън. Във възбудено състояние, атомът е само за кратко време може да живее. Развълнуван атом, като енергията се връща в основно състояние.
Взаимодействие, в противен случай акцептор връзката донор-акцептор донор; координация връзка - взаимодействие, на базата на трансфера на зареждане или електронен трансфер от донора на акцептор на чифт.
Донор-aktseptoronoe взаимодействие включва случаи събират трансфер между донорни и акцепторни молекули без образуване на химични връзки между тях и прехвърлят неразделен електронна двойка на донора до акцептор, в резултат на образуването на връзка.
В първия случай тя може да бъде, например органичен донор, по-специално - от донори, например, тетракис (диметиламино) етилен (TDAE), други ненаситени аминови съединения, металоцени и т.н., и органични акцептори като фулерени или quinodimethane акцептор .. заместители. В реакцията на такива съединения, в комплекс с пренос на заряд, където отрицателно зареден акцептора и донора взаимодействат положително заредена електростатично. Важна роля играе такава система, където в земята прехвърлянето на електронната държавна такса е само частична, а след това държавата с почти пълен пренос на заряд може да се произвежда от фотовъзбуждане. Такива системи, донор-акцепторни diads и триади, в която между донора и акцептора въведена мостова група допринася за състоянието на живот на прехвърлянето на зареждане могат да бъдат използвани за създаване на устройства за преобразуване на слънчевата енергия (вж., Например, изкуствена фотосинтеза). В общи линии, превоз на зареждане в различните му форми и проявления, играе ключова роля в много биологични процеси.
Във втория случай, донора и акцептора са, съответно, с киселина и основа на Люис. Ако нормално ковалентна връзка между два атома общи поради образуването на електронни двойки - по един от всеки атом, връзката донор-акцептор се извършва от двойка донор на електрони и свободни (незаети) акцепторни орбитите. Този тип на донор-акцептор взаимодействие - основния процес за образуване на комплексни съединения (фиг.). Такова взаимодействие е отговорна за много киселина-база преобразуване, свързана с предаването на водороден йон (акцептор), както и образуването на супрамолекулни наноструктури.
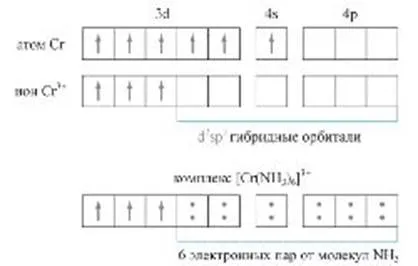
Насоченост ковалентна връзка е резултат от аспирация атоми за образуване на силна връзка най-вероятно се дължи на по-висока електронна плътност между ядрата. Това се постига чрез пространствена ориентация на припокриването на електрони облаци, което съвпада с тяхната собствена. Изключение е и електрони облаци, тъй като техният сферична форма прави всички посоки равни. За р- и г-електрон облаците припокриването се извършва по протежение на оста на които се удължава и формира в тази връзка се нарича # 963; -връзките. # 963; -Контрол на достъпа има аксиална симетрия и два атома могат да се завъртат по връзката, т.е. че една въображаема линия, която преминава през центъра на химически свързани атоми.
След образуване между два атома # 963; -връзките към останалата част на електрона облаци същата форма и със същата главно квантово число * остава само възможността за странично припокриване от двете страни на връзката. Резултатът е π-връзка. Това е по-малко силен от # 963; -Контрол на достъпа: припокриване дифузни орбитали на страничните части. Всяка множествена връзка (например, двойна или тройна) винаги съдържа само един # 963; -връзките. номер # 963; -връзките, която образува централната атом в комплексните молекули или йони, неговата стойност определя броя на координация. Например, една молекула на NH3 и NH4 + йон за азотният атом е равно на три и четири. образуване # 963; -връзките определя пространствено позицията на атоми един спрямо друг, така че броят на # 963; -връзките и ъглите между линиите за връзка, които се наричат валентните ъгли определят геометрична конфигурация молекули пространствени.
При оценката на степента на припокриване на електронните облаци трябва да се разглежда признаци на функциите на вълните на електроните *. Когато припокриването на облаци с едни и същи признаци на функциите на вълните на електронната плътност в пространството между увеличава ядра. В този случай е налице положителна припокриване, което води до взаимно привличане ядра. Ако признаците на функциите на вълната на обратното, плътността на електронен облак се намалява (отрицателен припокриване), което води до взаимно отблъскване на ядрата.
Йонна връзка - ковалентна специален случай, когато образуваната електронна двойка е изцяло собственост на повече електроотрицателна атом превръща анион. Основата за избор в това отношение, по-специално тип е, че съединения с такава връзка може да бъде описан в електростатичния сближаване, приемайки, йонна връзка, причинени от привличането на положителни и отрицателни йони. Взаимодействието на йони на обратен знак не зависи от посоката и силата на Кулон не са собственост на насищане. Следователно, всеки йон в йонната съединение привлича редица йони на обратен знак, за да се образува кристална решетка йонен тип. В йонна кристални молекули там. Всеки йон е заобиколен от определен брой йони на обратен знак (координационната броя на йона). Йонни двойки могат да съществуват в газообразно състояние под формата на полярните молекули. Газообразният NaCl има диполен момент
3 # 8729; 10 -29 Cl # 8729; m, която съответства на изместване на 0.8 електронен заряд от дължината на връзка от 0.236 пМ за Na CI, т.е. натриев хлорид 0,8- 0,8 + ...
В допълнение към различните heteropolar и си отиват-meopolyarnyh отношения, има и друг специален тип комуникация, която през последните две десетилетия привлича все повече внимание на химиците. Това се нарича водородна връзка. Установено е, че водородният атом може да образува връзка между две електроотрицателни атоми (F, О, N, CI и по-малко S). Има случаи, когато тази връзка представлява водороден атом, свързан към въглероден атом в тип съединения NSKH3, където х - електроотрицателна атом или група (например HCN, флуоровъглероди). Въпреки че понастоящем естеството на връзката водород все още не е напълно изяснен, odna.ko дефинирани двумерен представяне на вече е възможно да се направи.
Връзката на водород се образува между електроотрицателни атоми, от които поне един има свободна електронна двойка, например:
Водородното свързване (означена с пунктир на три точки).
По този начин връзката на водород е по природа, както изглежда, на електростатични; е образувана от привличането ковалентно свързани протонни свободни електрони на друга молекула атома. В този случай, протона не е в средата между атомите им свързване (дори ако те са същите), и по-близо до атом, към който е ковалентно свързан. Например, в случай на вода
едно разстояние, равно на О-Н 0.99 А и 1.76 А. Други
Въпросът дали водородът е във фиксирано положение, или се колебае между две равновесни позиции, в общия случай все още е неясна, въпреки че проучването на хинхидрон индикаторния показателно за фиксирана позиция на връзката на водород в това съединение е водород.
водородно свързване енергия е малък; е от порядъка на 5-10 Kcal / мол, докато, например, нормална комуникация енергия О-Н е 109 ккал / мол, както и комуникация Н-F 148 ккал / мол. На разтопяване на леда разгражда около 15% от водородните връзки чрез нагряване на вода до 40 ° С в продължение на паузи около половината водородни връзки. На водна пара на водородни връзки почти няма. При топене, водородните връзки са счупени алкохоли малко, но те са напълно откъснати по време на тяхното изпаряване. автомобили хлъзгав киселини, водородни връзки не са разделени, и изпаряване, така че, например, мравчена киселина в парна фаза съществува като димер
Въпреки това, в този случай, енергия на водородна връзка е само около 7 ккал / мол.
Наличието на водородна връзка има значителен ефект върху физическите свойства на съединенията. Това означава, че водородните връзки са отговорни за асоциирането на вода и алкохоли, и следователно тяхната необичайно висока точка на кипене относително, например с водороден сулфид и меркаптани. Способността на алкохоли, амини, карбоксилни киселини, амиди се разтварят във вода, поради образуването на водородни връзки с водните молекули. Някои съединения, като atsetouksus-Nogo естер енолна форма, о-нитрофенол и други. Форма вътрешномолекулни водородни връзки с цикъла на затваряне. Изследване на водородни връзки трябва да хвърли повече светлина върху структурата и свойствата на много органични вещества.
Флуорът берилий Бъдете F (2) - стъкловиден материал. Неговата структура се състои от нарушено мрежа на берилий атоми (КН 4), свързани с мостове на флуорни атома, и подобен на този от кварцово стъкло. Над 270 ° С берилий флуорид спонтанно кристализира. Като кварц, тя съществува в ниската температура на форма, която е 227 ° С, влиза в б-форма. Можете също така да получите формата на кристобалитни и tridymite. Структурните сходства между SiO2 и BeF2 също се простира до fluoberyllates (които се получават чрез взаимодействие на берилий флуорид с флуориди на алкални елементи и амониев) и силикати. Берилиев флуорид - fluoberyllate стъкло компонент и сол смес се използва в ядрените реактори, стопена сол.
Една молекула вода се състои от два атома водород (1Н) и един атом кислород (16O). Оказва се, че почти всички свойства разнообразие от вода и техните необичайни прояви се определя, в крайна сметка, физическата природа на тези атоми, техния метод на асоциация и групиране в молекулата образуван отделно считат molekul.V вода молекула водород и кислородни атоми, или по-скоро са разположени техните ядра така че да образуват равнобедрен триъгълник. В горната част на това - относително голям кислород сърцевина от ъглите съседни към основата, - едно ядро vodoroda.V съгласно електронната структура на атома на водород и кислород молекула вода има пет електронни двойки. Те образуват електронен облак. Облакът е нехомогенен - е възможно да се разграничат отделните кондензацията и разреждането. В основата на кислород създава излишък на електронната плътност. Вътрешна електронна двойка на кислород равномерно обгражда ядрото: тя е представена схематично окръжност с център - основната O2-. Четири външни електрони са групирани в две двойки електрони, се насочват към сърцевината, но отчасти не компенсира. Схематично, общите електрон орбитите на тези двойки са показани като елипси, простиращи се от обща център - O2-ядро. Всеки от останалите два кислородни образува двойка електрони от един електрон водород. Тези двойки са привлечени към ядрото на кислород. Следователно, водородни ядра - протони - са малко голи, и тук съществува недостиг на електронен plotnosti.Takim, четири полюса на таксите се различават в една молекула вода: два отрицателен (излишък на електронната плътност в ядрото на кислород) и две положителен (липса на електронна плътност в два водородни ядра ). За по-голяма яснота, ние можем да си представим, че полюсите заемат върховете на деформиран тетраедър, в центъра на която е ядро на кислород