Молекулярна-кинетичната теория

Започвайки от XVIII век, постепенно започна да се разработи система за научни идеи за структурата на материята, по-късно наречен молекулно-кинетичната теория (ICB). Молекулярна-кинетичната теория се основава на три позиции, обобщаващ резултатите от голям брой експериментални данни:
Всички органи са съставени от малки частици - атоми, молекули и йони. По този начин, всяко вещество е дискретна структура.
Частиците, които вещество са в постоянен случаен движение, който се нарича топлина.
Атоми, молекули и йони взаимодействат един с друг.
Помислете за ситуацията в по-големи подробности.
Молекулярната структура на веществото. Mole на вещество. Числото на Авогадро. Количеството вещество.
Съвременната физика не определят граници структурна делимост на материята, обаче, ясно посочва, че елементите, които определят основни физически свойства на органи са атоми, молекули и йони.
Atom е най-малката частица на даден химичен елемент, в неговите носители свойства. Всеки химичен елемент има своя собствена атом.
Молекула - стабилна малката частиците на веществото с неговите основни химични свойства. Молекулата се състои от атоми от еднакви или различни химични елементи.
Ion - електрически заредена частица, която се образува от загубата или придобиването на атомите и молекулите на един или повече електрони.
Атомна структура са инертни газове (хелий, аргон и т.н.), Течни (живак) и твърди частици (мед, диамантени). Редица кристални вещества, такива като натриев хлорид, се състои от противоположно заредени йони. Въпреки това, по-голямата част от вещества е оформен от молекули (въглероден диоксид, вода), така че терминът "молекула" често се използва като общ термин колективно.
Modern експериментална техника позволява да се наблюдава молекулярната структура на веществото, както и за определяне на размера на атомите и молекулите. Тези размери са много малки, защото атомите са от порядъка на 10-10 м, за молекули на много широк диапазон - 10-10 м за прости молекули до 10-5 М за сложни молекули на органични вещества.
Естествено, с такива размери, масата на атома и молекули, също е много малка, например, масата на молекулата на водород е 3.3 · 10-27 кг. Разбираемо е, че работи с такива стойности не е много удобно в практически изчисления.
Следователно, понятието относителна молекулна (атомен) тегло е въведена г, която се определя като отношението на масата на молекулата (атом) на веществото 1/12 на маса m0 въглероден атом :. (1)

Броят на молекули в случай на система един компонент. съдържащ молекули или атоми от един вид може да се намери чрез формулата:
, където m - масата на системата, изразена в килограми.
От тази формула се вижда, че N има много голяма стойност, така че въвеждането на изисква относително параметър, свързан с броя N на молекули в системата, наречена количеството на веществото.
Международната система единици (SI) по такъв параметър премина мол - количество на веществото, който съдържа същия брой молекули или атоми, като атоми, съдържащи се в 0,012 кг въглерод.
По този начин, един мол от всяко вещество съдържа същия брой молекули или атоми, който се нарича номер (постоянна) и е равна на Авогадро:
Количеството вещество п е дефинирана като броя молове равен на броя на молекули спрямо Авогадро номер N :. (2)
Тегло на един мол от вещество, наречено молекулно тегло. Тя е равна на произведението на масата на една молекула m0 вещество от броя на Авогадро: M = m0 · NA (3)
и измерена в килограми за мол: [М] = кг · мол-1.
От (1), (3) и определянето на броя на Авогадро, следва, че между относително молекулно тегло н вещество и моларното съотношение маса М съществува: M = н · 10-3 кг · мол-1.
Предвид М равенство = N · m 0, където m - маса на материала съгласно формули (2) и (3) е лесно да се получи друг изразяване на количеството вещество: (4)
т. е. количеството вещество равна на масата на веществото своята молекулна маса.
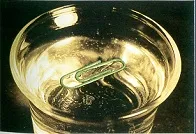
Термичната движение на молекули. Объркване, хаотично движение на частиците - най-важната характеристика на топлинната движение. Експериментално доказателство за непрекъснатия характер на молекулното движение е дифузия и брауново движение.
Diffusion - явление спонтанно проникване на молекули на едно вещество в друга.
В резултат на взаимна дифузия на веществата е постепенното привеждане на концентрацията им във всички области на силата на звука, която заемат.
Установено е, че скоростта на процеса на дифузия зависи от вида и температурата на дифузионната вещества. Едно от най-интересните явления потвърждаващи хаотично движение на молекули е брауново движение. Това е микроскопска топлинна движение (но, състояща се от много голям брой молекули) частици вещество в суспензия в течност или газ, P. Browne първия наблюдава. Смущение движение на тези частици, поради факта, че сумата от импулси, получени от тях от молекули от различни страни може да бъде различна от нула в резултат на различен брой удари от различни страни на частицата, и в резултат на частицата от една страна може да достигне молекули, притежаващи по-висока скорост от молекули, я удари от другата страна. Брауново движение се проявява по-забележимо, по-малките частици и вискозитет на средата, и по-висока от температурата на системата. Температура зависимост показва, че скоростта на случаен движение на молекулите увеличава с повишаване на температурата, поради което тя се нарича топлинна движение.
Взаимодействието на молекули. Междумолекулни сили са електромагнитни в природата и могат да бъдат сведени до два вида - привличане и отблъскване. Тези сили са къси разстояния и показват само на разстояние сравними с размерите на молекулите. Атрактивни и отблъскващи сили намаляват бързо с нарастване на разстоянието между молекулите, но тяхната скорост на намаляване варира. отблъскване сила доминира в малки разстояния и за неопределено време увеличава като приближава разстояние R между центровете на масата на молекули до определена стойност на г. което може да се разглежда като ефективно молекулярен диаметър. Силата на привличане намалява с увеличаване на R много по-бавно отблъскваща сила, така че има някои стойност в междумолекулна разстояние R = на r0. където отблъскване и привличане сили неутрализират взаимно, така че резултантната сила на междумолекулна взаимодействието става нула.
Промяна на агрегатно състояние на веществото