Митохондриални заболявания (tsitopatii)
Митохондриални заболявания - група наследствени заболявания, свързани с дефекти в работата на митохондриите, които водят до нарушения на енергия функции в еукариотни клетки, по-специално на човека.
Митохондриални заболявания са предизвикани от генетични, структурни, биохимични дефекти в митохондриите, водещи до смущения на тъкан дишане. Те се предават само по женска линия на децата от двата пола, като трансфер на зиготи сперма половината от ядрения геном, и яйчни доставки, както и втората половина на генома и митохондриите. Патологичните разстройства на клетъчна енергия метаболизъм може да изглежда като дефекти на различни единици в цикъла на Кребс, дихателната верига, процесите на бета-окисление, и така нататък. D.
Не всички ензими и други контроли, необходими за ефективно функциониране на митохондриите са кодирани от митохондриална ДНК. Повечето от митохондриалните функции контролирани ядрени.
могат да бъдат идентифицирани две групи митохондриални заболявания:
Изразени наследствени синдроми, причинени от мутации в гените, отговорни за митохондриални протеини (синдром на Barth, синдром на Kearns-Sayre, синдром на Pearson, синдром на MELAS, синдром MERRF, и други).
Средни митохондриални заболявания включват заболявания на клетъчна енергия обмен като важна връзка образуване патогенеза (заболяване на съединителната тъкан, синдром на хронична умора. Гликогеноза, кардиомиопатия. Мигрена. Чернодробна недостатъчност, панцитопения, и хипопаратироидизъм. Diabetes, рахит и други).
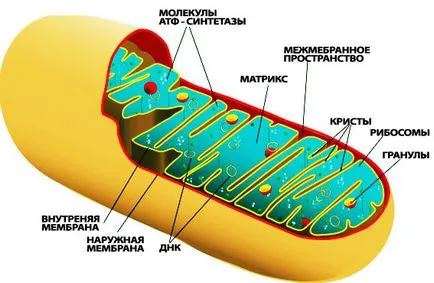
Причините за митохондриални заболявания:
Митохондриално увреждане voznikaetnbspnbsp главно поради ефектите на реактивни кислородни видове (ROS). Сега се смята, че повечето от РОС образува комплекси I и III, вероятно се дължи на освобождаването на електрони под влиянието на NADH и FAD-H в СРЕ. Митохондриите използват около 85% кислород, консумирана от клетка, по време на образуването ATF.nbspnbsp При нормална protsessanbspnbsp PF от 0.4% до 4.0% от консумираната кислород се превръща в митохондриите на супероксидни радикали (O2-). Супероксид се трансформира до водороден пероксид (Н2О2) чрез детоксикация ензим nbspnbsp манган супероксид дисмутаза (Mn-SOD) или цинк / мед-супероксид дисмутаза (Cu / Zn СОД), - и след това с вода с помощта на глутатион пероксидаза (HP) или peroksidredoksina III (OL III). Въпреки това, ако тези ензими, които не са в състояние да конвертира достатъчно bystronbspnbsp ROS като супероксиден радикал с вода настъпва окислително увреждане и се натрупва в mitohondriyah.nbspnbsp глутатион в PR е един от основните антиоксидант в тялото. Глутатион е трипептид, съдържащ глутамин, глицин и цистеин. SE изисква селен като кофактор.
Доказано е, ин витро сто супероксидни вреди желязо сяра клъстери в активния сайт aconitase, fertenta ТАС цикъл. Поради това, желязото реагира с Н2О2 за образуване на хидроксилни радикали чрез реакцията на Фентън (Фентън). Освен това, азотен оксид (NO), получен в митохондриите, използвайки митохондриална азотен оксид синтаза (STPS) и свободно дифундира в митохондриите от цитозола. NO реагира с O2 да образуват друг radikala- пероксинитрит (ONOO-). Заедно тези два радикала и други радикали могат да причинят значителни вреди на митохондрии и други клетъчни компоненти.
Митохондриите на елементи, които са изложени на свободни радикали са липиди, протеини, ензими и редокс мтДНК. Директен увреждане на митохондриални протеини намалява техния афинитет за субстрати или коензими, и по този начин да наруши тяхната функция. Проблемът се усложнява и от факта, че ако настъпили митохондриите на щети, функцията на митохондриите може да бъде компрометиран от увеличение на клетъчната енергийните нужди за възстановителни процеси. Митохондриална дисфункция може да доведе до процес верига, в която митохондриално увреждане води до допълнително увреждане.
Комплекс I е особено чувствителна към ефектите на азотен оксид (NO). При животни, третирани с естествени и синтетични антагонисти на комплекс I, като правило, наблюдавано невронална смърт. Нарушената функция на комплекс I е свързано с Лебер наследствена оптична невропатия, болест на Паркинсон и други невродегенеративни състояния.
Хипергликемия индуцира образуването на супероксид в митохондриите на ендотелни клетки, което е важен медиатор на диабетни усложнения, такива като сърдечно-съдови заболявания. образуване на супероксид в ендотела и допринася за развитието на атеросклероза. хипертония, конгестивна сърдечна недостатъчност. стареене, сепсис. ishemicheski- реперфузионно увреждане и хиперхолестеролемия.
Възпалителните медиатори като тумор некрозис фактор # 945; (TNF # 945) ин витро са свързани с митохондриалната disfunktsieynbspnbsp и повишено образуване на KGF. В модела на застойна сърдечна недостатъчност nbspnbsp добавяне на TNF # 945; културата на кардиомиоцити повишено образуване на ROS и миоцит хипертрофия. TNF # 945; disfunktsiyunbspnbsp причинява митохондриална комплекс III чрез редукция на СРЕ активност при увеличаване на образуването на ROS и мтДНК увреждане.
Хранителен недостиг или излишък може да доведе до митохондриалната дисфункция. Витамини, минерали и други метаболити, действат като кофактори, необходими за синтеза и функционирането на митохондриалните ензими и други компоненти, които поддържат митохондриалната функция и microcomponents диета възстановяване mozhetnbspnbsp митохондрии ускоряване стареене и допринасят за невродегенерация. Например, ензими, участващи в синтеза на хем вериги, изискват достатъчно количество пиридоксин, желязо, мед, цинк и рибофлавин. Липсата на хранителни вещества, необходими за ТАС цикъл на всички компоненти или CPEs, може да доведе до повишено образуване на свободни радикали и увреждане мтДНК.
Добре известно е, че липсата на хранителни вещества е често срещана причина за патогенезата на много заболявания и е основният въпрос в zdravoohranenii.nbspnbsp Iron главен недостатък посредник в развитието на общата тежест на заболявания, засягаща около 2 милиарда души, предимно жени и деца. Това е най-често срещаният тип на хранителен дефицит. Ниската състоянието на съдържание на желязо намалява mitohondriynbspnbsp на активност чрез завъртане комплекс IV и uvelicheniyanbspnbsp оксидативен стрес. Механизмите основата на процес влияние хранителна недостатъчност (и в някои случаи като излишък на желязо в) в случай, развитието и прогресирането на заболявания, произтичащи от нарушения на митохондриални функции, вече са изследвани.
Наследяване на митохондриални заболявания:
Митохондриите са наследени по различен начин от ядрени гени. Ядрени соматични гени във всяка клетка е обикновено представени от две алели (с изключение на най-на секс-свързан ген в heterogametic пол). Един алел наследена от бащата и един от майката. Въпреки митохондрии съдържат собствена ДНК, където всеки човешки митохондрии обикновено съдържа от 5 до 10 копия на ДНК кръгова молекула (вж. Heteroplasmy), всички на митохондриите се наследява от майката. Когато митохондриите са разделени, копия на ДНК се разпределят на случаен сред потомците й. Ако само един от оригиналната ДНК молекула съдържа мутация, в резултат на случайно разпределение на тези мутантни молекули могат да се натрупват в някои митохондриите. Митохондриална болест започва да се появява по време, когато значителен брой на митохондриите в много клетки на тъканта става мутантни копия на ДНК (праг на експресия).
Мутации в митохондриалната ДНК се появят по различни причини, по-често от ядрената. Това означава, че митохондриална болест често се дължи на спонтанни мутации нововъзникващите. Понякога увеличения процент мутация поради мутации в ядрени гени, кодиращи ензими, които контролират репликацията на митохондриална ДНК.
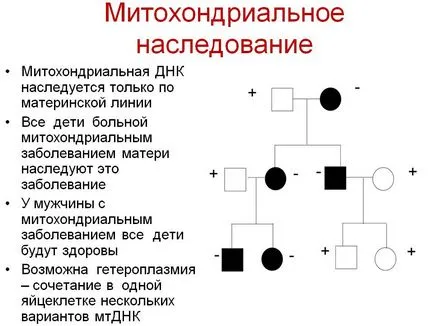
Генетични аспекти на митохондриални заболявания
Симптомите на митохондриални заболявания:
Ефекти на митохондриални заболявания са много разнообразни. Поради различното разпределение на дефектни митохондрии в различни органи на мутация в един човек може да доведе до заболяване на черния дроб, а другият - заболяване на мозъка. Големината на поява дефект може да бъде голям или малък и може да варира значително, докато нараства бавно с течение на времето. Някои малки дефекти водят само до невъзможност на пациента да се поддържа физическа активност за тяхната възраст и не са придружени от сериозни неблагоприятни ефекти. Други дефекти могат да бъдат по-опасни, което води до сериозна патология.
Като цяло, митохондриални заболявания са по-тежки от локализацията на дефектни митохондрии в мускулите, мозъка, нервна тъкан, тъй като тези органи изискват много енергия за изпълнение на съответните функции.
Въпреки факта, че потокът на митохондриални болести са много различни за различните пациенти, основани на общи симптоми и специфични мутации, които причиняват болести, няколко основни класове на тези заболявания.
В допълнение към относително често митохондриална миопатия. намерени:
1. диабет митохондриални. придружено глухота (DAD, Midd, синдром на MELAS) - комбинация, се проявява в може да бъде причинено от мутация на гена митохондриална МТ-TL1 ранна възраст, но диабет и глухота могат да бъдат причинени от митохондриални заболявания, и други причини;
наследствена оптична невропатия 2. Лебер, характеризиращо се със загуба на зрение в началото на пубертета;
4. множествена склероза и други заболявания;
5. Leigh заболяване (Leigh) или подостри некротизиращи encephalomyopathies. след първоначален нормално постнаталното развитие на заболяването обикновено се появява в края на първата година от живота, понякога - в зряла възраст. Заболяването придружава от бърза загуба на функциите на тялото и се характеризира с конвулсии, нарушена състояние на съзнанието, деменция, спиране на дишането;
6. невропатия. атаксия. ретинит pigmentos и птоза: прогресивни симптоми невропатия. атаксия. тесногръдие и загуба на зрение, птоза, деменция;
7. neyrogastrointenstinalnaya митохондриалната енцефалопатия. стомашно псевдо-обструкция и кахексия, невропатия. енцефалопатия с промяна на бялото вещество на мозъка.
Лечение на митохондриални заболявания:
Понастоящем лечението на митохондриални заболявания в стадий на развитие, но общата терапевтичен подход е симптоматично профилактика с витамини. По-специално, за лечение на синдром на MELAS при някои пациенти се оказаха ефективни коензим Q, който се използва като антиоксидант и cytoprotector с кардиомиопатия и конгестивна сърдечна недостатъчност. рибофлавин и никотинамид. Също така, като един от методите, използвани пируват.
Понастоящем пилотни проучвания относно възможността за ин витро (ин витро) оплождане използват химерен яйце, ядрото на който е получен от яйчен на пациента с митохондриална болест, и цитоплазмата на яйцеклетката от други жени с нормално функциониращи митохондрии (замяната на ядрото).