Лекция въглероден ви коте
Карбоксилни киселини са кислород-съдържащи органични съединения, чиито молекули съдържат една или повече функционални карбоксилни групи - СООН.
По броя на тези групи се отличават едно-, дву-, три- или повече основни киселина.
Общата формула на ациклени монокарбоксилни киселини R-COOH серия, ароматен - Ar-СООН, където R- наситени и ненаситени радикали в граница серия (наситен) и ненаситени (ненаситени карбоксилни киселини), Аг - фенилов радикал, - С6 Н5.
Ограничаване едноосновен киселина
Имената на прости карбоксилни киселини често се свързва с източниците, от които те се изолират за първи път: мравчена киселина от мравки, оцетна киселина, оцет и т.н. По-сложни карбоксилна киселина може да се счита като производни на оцетната киселина и изискват рационално номенклатура.
Чрез систематични имена номенклатура произвеждат карбоксилни киселини от наситени въглеводороди имена (със същия брой въглеродни атоми), допълнена с затваряне -ovaya киселина и думи. Основната верига е номерирана от въглерода на карбоксилната група.
Изомерия на карбоксилни киселини зависи от структурата на въглеродния скелет свързана с карбоксилната група.
Най-важните общи методи за получаване на карбоксилни киселини са:
1) лимит окисление (парафинов) въглеводороди с въздух или технически кислород при високи температури, в присъствието на, като правило, катализатори:
2) взаимодействие на олефини с въглероден монооксид (P) и пара за получаване на:
3) окисление на първични алкохоли, алдехиди, кетони:
4) Синтез чрез органометално съединение и СО2:
5) хидролиза (осапунване), нитрили (R-C = N):
6) осапунване на естери:
Химичните свойства на карбоксилна киселина
Много от свойствата на карбоксилна киселина поради наличието в техните молекули карбоксилна група е силно поляризиран. По този начин, кислороден атом, свързан към въглерод двойна връзка е по-електроотрицателна дърпа електрони π-връзка, което води до образуването на отрицателен заряд на кислорода. Въглероден атом, получаване на някои положителен заряд привлича свободна електронна двойка на кислородния атом на групата -ОН. Това води до изместване и смекчаване комуникация σ-кислород водород, и да се проявяват подчертано киселина характер на карбоксилни киселини.
Водните разтвори на карбоксилни киселини се разпадат в йони като минерални киселини, за да образуват хидрониев йони:
Степента на дисоциация (йонизация) и, следователно, силата поради количеството на карбоксилна киселина и радикал характер, както и влиянието на заместители, разположени в близост до карбоксилната група.
Заместители като -OH, -Vg, -С1, -NH2. -NO2, -СООН, -SOOR (проявяват негативно индуктивен ефект -Ief) увеличаване силата на киселини, други - въглеводородни радикали (IEF +) - намалява степента на дисоциация. В действителност, степента на дисоциация на хлорооцетна киселина (III) е около 10 пъти и оксалат (II) в 50 пъти по-големи от оцетен (IV) киселина. Трихлороцетна киселина (I) чрез дисоциация степен сравнима с минерални киселини.
Органични киселини образуват множество функционални производни на σ-PR карбоксилни групи, а именно:
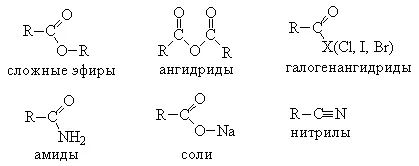
2. Получаване на соли. Карбоксилни киселини имат всички свойства на конвенционални киселини. Те реагират с активните метални Lamy, основни оксиди, соли на слаби основи и коте Lot:
RCOOH + NaOH → RCOONa + Н 2О,
Карбоксилна киселина - слаб, обаче, силни минерални киселини ги изместват от съответната сол:
СН3 COONa + HCl → CH 3 COOH + NaCl.
Соли на карбоксилни киселини във водни разтвори на хидролизиран:
СН3 COOK + H 2 O CH 3 COOH + КОН.
За разлика от карбоксилна киселина с минерална е възможността за образуване на редица функционални производни.
3. Получаване на функционални производни на карбоксилна коте много. Чрез заместване на ОН групите в различни карбоксилни киселини-ционни групи (X) са оформени функционални производни на киселини с обща формула R-CO-X; тук R е алкилова група. Въпреки че други нитрили имат обща формула (R-CN), обикновено те са също така разглежда като раса-карбоксилова киселина производни на защото те могат да бъдат получени от тези киселини.
Хлориди хлорид, получен чрез действието на фосфор (V) киселина:
R-CO-ОН + РСЬ 5 → R-CO-CI + РОСЬ 3 + HCI.
НСООН мравчена киселина има редица функции, като в състава е алдехидна група:
Мравчена киселина - силен редуциращ агент и лесно-оксиди желаят да се създаде на СО2. Тя дава реакцията на "сребърно огледало":
или в опростена форма:
В допълнение, мравчена киселина се окислява с хлор:
карбоксилна киселина на кислород атмосфера окислява до СО2 и Н2 О:
6. Реакцията на декарбоксилиране. Наситен незаместен монокарбоксилна киселина поради високата якост на С-С декарбоксилира чрез нагряване с трудност. За тази q.s. Димо слят-алкална метална сол на карбоксилна киселина с алкален:
Ненаситена едноосновен киселина.
Ненаситена едноосновен киселина включва ненаситен въглеводороден радикал, свързан с карбоксилната група.
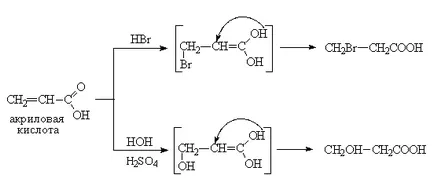
Общата формула на тези киселини с една двойна връзка Cn H2N-1 СООН. Молекулата на ненаситени карбоксилни киселини могат да съдържат две или повече етиленови връзки, както и тройна връзка. Примери за такива киселини са: акрилова киселина, СН2 = СН-СООН, метил акрилова киселина, СН2 = С (СН3) СООН, кротонова киселина СН3 -СН = СН-СООН, сорбинова киселина, СН3 -СН = СН-СН = СН-СООН, пропиолова CH≡C-СООН киселина и по-високо ненаситени киселини (олеинова, линолова и линоленова киселина).
Изомерите на тези киселини е подобен изомерия ненаситени въглеводороди.
Акрилова киселина СН2 = СН-СООН, съдържащ три въглеродни атома все още няма изомери и ненаситени киселини с четири въглеродни атома има три изомери:

Кротонова киселина, освен това, могат да съществуват като два геометрични (цис-транс) изомери:
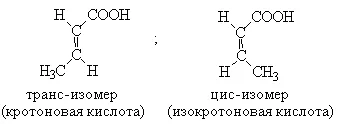
Номенклатурата на тези киселини се свързва най-вече с тривиални имена. Според системното номенклатурата на имената им образуват името на съответните ненаситени въглеводороди и край -ovaya:
Първи. Ненаситените едноосновни киселини могат да бъдат получени по следните методи.
1. Въведение в съединения, съдържащи двойни връзки, карбоксил:
2. Въвеждане на двойната връзка в съединение, съдържащо карбоксилна група:
Химичните свойства на ненаситени монокарбоксилни киселини се определят от двойна връзка и карбоксилна група. Следователно, ненаситени киселини могат да проявяват свойства като конвенционални киселини и ненаситени съединения. По този начин, те влизат в допълнение реакцията окисление и полимеризацията. Въпреки това, карбоксилна група, е силно електрон акцептор, намалява двойната връзка на активност (изчерпва неговата електронна плътност) в реакциите на електрофилни съединения. Следователно, прикрепване на халогеноводороди на ненаситени карбоксилни киселини като конюгиран етиленови двойни връзки и (α, β-ненаситена киселина) и техния вид хидратация са 1,4-допълнение (правило анти-Markovnikov).
Двуосновен или дикарбоксилна, пределната (alkadiovye) и ненаситен (alkediovye) киселина.
Двуосновен или дикарбоксилна киселини съдържат в молекулата две карбоксилната група: HOOC-R-COOH.
В зависимост от природата на радикала R дикиселините може да бъде наситен и ненаситен.
Номенклатура. Киселините с поредицата често имат собствени имена, например:
НООС-СН2-СООН - ябълчена
Според системното номенклатурата на името двуосновни киселини е от съответните въглеводороди и крайните заглавията
-diovaya думи или дикарбоксилна киселина:
Изомерия ограничаване дикарбоксилни киселини зависи от структурата на въглеродната верига, към който са свързани две карбоксил, ненаситен и - позицията на двойната връзка във веригата. Освен това, ненаситени диациди, ненаситен едновалентен като могат да съществуват като два геометрични (цис и транс) изомери. Например, най-простите ненаситен двуосновен киселина НООС-СН = СН-СООН (етилен-1,2-дикарбоксилна) съществува в транс форма (фумарова киселина) и цис-форма (малеинова киселина):

Методи за получаване на по принцип двуосновни киселини не се различават от методите за получаване на моноосновен. Въпреки това, в подготовката им като изходен материал се използва съединение с две функционални групи, обратими на карбоксил:
Химичните свойства на дикарбоксилни киселини, определени от присъствието в молекулата, две карбоксилни групи и в случая на ненаситени двуосновни киселини, също двойна връзка. Карбоксилна група влияние помежду си, увеличаване на киселинните свойства на тези киселини. Най-силните сред дикарбоксилни киселини са оксалова киселина (това е много по-силна, например, оцетна киселина).
Химичните свойства на двуосновни киселини е до голяма степен подобни на свойствата на моноосновен. Те образуват соли, естери, киселинни хлориди, и т.н. Въпреки това, има две карбоксилни групи, тези киселина, способна да образува две серии от производни: кисела среда и соли, естери киселина и средни, и др ..
Дикарбоксилни киселини и имат специфични свойства, които зависят от взаимното влияние на две карбоксилни групи. По този начин, по време на разлагане, те образуват различни продукти, естеството на които се определя от взаимни карбоксили за местоположение. Киселина, където тези групи са съседни (1,2-позиция) или да се изхвърлят чрез една метиленова група (1,3-позиция), при температура над температурата на топене се подложи на декарбоксилиране:
Важен представител на редица ограничаване дикарбоксилна киселина действа като адипинова киселина НООС- (СН2) 4 -СООН. Когато кондензация с хексаметилен диамин Н2 N- (СН2) 6 -NH2 образува макромолекулното съединение - полиамид, който се произвежда от -naylon синтетично влакно (anide).
Найлон (полиамид 66, полиамид 66 - Engl найлон найлон. Найлон 6, найлон 6 - найлон) - синтетичен полиамид благоприятно използван в производството на влакна.
Има теория, че думата "найлон" произлиза от името на град Ню Йорк и Лондон (найлон = N EW Y Ork + дълж дон). Също така има становище, че е думата - абревиатура на Ню Йорк Lab на органични нитросъединения. Въпреки това, надеждна информация за това. В речник на Уебстър се казва, че това изкуствено измислена дума.
Има два изомерна форма найлон: anide (найлон-66) и найлон (полиамид-6).

Фиг. Capron 1. (горе) и найлон-66 (долу).
Найлон има следните характеристики: