Laba повикване
Biochem, четири години, група 1, 2 подгрупа
Лабораторни упражнения №5.
Адсорбция на течната фаза - газ.
Определяне на повърхностното напрежение на разтвори. Изграждане на изотерма на повърхностното напрежение σ = F (и). Изчисляване на адсорбция стойности Т в различни концентрации. Изграждане на адсорбционните изотерми Т = е (S). Графично определяне постоянен Langmuir уравнение (к и G∞) и изчисляване на дебелината делта адсорбционната слой и повърхността, заета от една молекула р.
Повърхността на фаза е винаги поле източник сила поради некомпенсирани молекулните сили в повърхностна слой. За преместване на единични течни молекули от по-голямата част на повърхността е необходимо да работят за преодоляване на тези сили, насочени навътре фаза с голям междумолекулна привличане. Следователно, въпросът за нова повърхност винаги е свързано с разход на труд. Тази работа идентифицира излишък свободната енергия на повърхността А и интерфейс в сравнение с енергията на обема. Този излишък, по площ единица се нарича специфичен свободната енергия и е означен с σ (J / m2).
Колоидни системи, като микрохетерогенност системи имат голяма повърхностна повърхност S и притежават значителна повърхност свободна енергия на Хелмхолц
Голяма стойност и колоидни системи определя неговата термодинамична нестабилност. Следователно, методите, придружени от намаляване на А и могат да се появят в колоидни системи. От уравнение (1), че намаляването на Както може да се получи както чрез намаляване σ и повърхност S. намаляване на σ се дължи на концентрацията на адсорбция вещество в повърхностния слой. Количеството T (мол / m 2) може да се определи от излишък на веществото в повърхностния слой в сравнение с разтвора:
където c0 и С - концентрация в повърхностния слой и насипно състояние; Vn - обем на повърхностния слой.
отношения и σ R се определя Gibbs уравнение:
където С - равновесна концентрация разтворено вещество, Mol / L; R - универсална постоянен газ (8.31 J / Molkov); Т - абсолютна температура.
Друг начин за намаляване на излишъка от повърхностната енергия А и - намаляване на площ S. Количеството S може да се намали поради повърхностни адхезионни явления на колоидни частици (коагулация, структуриране и рекристализация). Този път води до смъртта на дисперсията.
От уравнение (3) следва, че се определя количеството адсорбция се редуцира до експериментално изследване на зависимостта на специфичната повърхностна енергия сигма на концентрацията на вещество в насипно състояние: σ = F (и). Стойност се нарича повърхностна активност. Той описва способността на дадено вещество да се промени специфичната повърхностна енергия. Вещества редуциращи σ, наречени повърхностно активни вещества (ПАВ); за тях г> 0, следователно T> 0 (положителен адсорбция). Като повърхностно активни вещества са алкохоли, органични киселини, естери, сапуни, и т.н. Вещество, което намалява енергията повърхност са известни като повърхностно неактивен (Pina); за тях г<0 и Г<0 (отрицательная адсорбция). К ПИНАВ относятся растворы сильных электролитов.
Положителни адсорбция играе огромна роля в природните и промишлени процеси. Той е един от етапите на хетерогенни каталитични процеси в химическата промишленост, с помощта на които понастоящем получават повече от 70% от химикали. Като се има предвид голямото значение на положителен усвояване, често под адсорбция се разбере точно положителна адсорбция. Зависимост на специфична повърхностна енергия или повърхностно напрежение на чисти течности с температура е описан от основното уравнение на термодинамиката повърхностни явления - Гибс уравнение:
където S S - излишък на ентропията в повърхностния слой; Гипс Gi и σi - адсорбция и химически потенциал на I-ти компонент.
Ако п = 1 (система течност-пара), тогава
Многобройни проучвания са показали, че S и е постоянно до критичната температура. Следователно, зависимостта на σ T линейна (Eötvös уравнение):
където Ts - температура, близка до критично.
Критичната точка е повърхностното напрежение, както е показано на Менделеев 1860 грам. Изчезва. Заедно с това отива до нула и излишната ентропия в повърхностния слой. Повърхностното напрежение на чиста вода с температура, ако температурата е далеч от критично, изразена чрез уравнението:
при което - повърхностното напрежение (J / т2) вода при температура Т.
Наличието на излишък от свободна енергия от извитата повърхност води до така наречените капилярни явления. Налягането в двете насипни фази, разделени с извита повърхност, са различни. Разликата между тези налягания, означена Ар се нарича капилярно налягане. В равновесно състояние налягането капилярна поради повърхностното напрежение на границата на σ фаза и неговите геометрични характеристики (главните радиуси на закръгление R1 и R2 на елипса на) уравнението получен в Лаплас 1805 г .:
Тя се прилага, ако извивката на радиуса на интерфейса е голям в сравнение с радиуса на междумолекулни сили. За сферична повърхност на R1 = R2 = R и Лаплас уравнение става по следната формула:
уравнение на Лаплас може да се използва за определяне на напрежение на течност повърхност на граничната повърхност с газ или друг несмесващ това течността. Метод определяне въз основа на измерване на максималното налягане, необходимо за принуждаване на балона газ чрез капилярна потопена в течността за изпитване (Фигура 1).
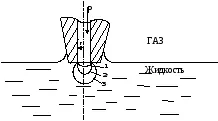
От фигура 1 се вижда, че първият намалява балон радиус (позиция 1-2) до R = R. след това се увеличи (позиция 2-3). Това означава, че чрез увеличаване на налягането в радиуса на балона минава през минимум. Съгласно уравнението на Лаплас R промяна трябва да се извърши през максимум при R = R. Когато максимално налягане Pmax газ балон става нестабилен и бързо се отделя от капиляра. напрежение на течност повърхност с газ и течност с плътност Pmax Cantor уравнение се дава:
Уравнение (10) се прилага, когато R <1мм. Для очень тонких капилляров, когда r ≈ 0,1 мм, уравнение (10) упрощается:
За двете течности с повърхностно напрежение и σ "уравнение (11) е:
където - е необходимо максималното налягане за образуване на мехурчета в течността, съответно 1 и течност 2. От уравнения (12):
Уравнение (13) позволява изчисляване неизвестен напрежение течност повърхност (σ "), знаейки максималното налягане Р" Стах за тази течност и за Rmax стандарт течност с известно повърхностното напрежение (например вода).
изотерма на адсорбция при интерфейса между течни и газообразни фази.
Уравнение (3) Гибс е един от основните уравнения на колоидна химия, която държи за всяка граница фаза. Широкото използване на това уравнение за проучвания на адсорбция на повърхността на течността с газ (или пара) поради относително лесно определяне на сигма течности. За директни методи твърди сигма не измерение.
След като се определи експериментално от а отношенията σ - повърхностно напрежение изотерма, и като се използва уравнението на Гибс, можем да намерим стойността на адсорбция при различни концентрации, т.е. адсорбционната изотерма.
Определяне на графичен метод G на уравнението на Гибс.
На изотерма избрания номер на повърхностното напрежение на точки, което се извършва и допирателна линия, успоредна на абсцисата на. Тъй допирателната е производно и от изграждането вижда chtotg = - = tg, след това се подлагат на Гибс уравнение (3) получаваме:
Графика на адсорбционната изотерма Т = F (в)
Зависимостта на адсорбция стойност е описан от уравнението Langmuir:
където G - ограничаване на адсорбция или адсорбция стойност при пълно насищане монослой повърхност адсорбция; к - константа на равновесие на адсорбция.
Определяне на характеристиките на повърхностния слой.
Стойностите на константите на уравнението Langmuir G и К са графичен метод. Уравнение (15) се превръща в линейна форма:
Изобразените в / г от С.
От уравнение (16) означава, че или
G стойност може да се намери с помощта на емпирични уравнението Shishkovsky:
където 0 - повърхностно напрежение на чиста течност А и В - постоянен.
Постоянен в уравнение (19) е свързан с G връзка:
За известни стойности 1 и Б в съответствие с уравнението (19) можем да изчислим постоянното уравнението А Shishkovsky и се уверете, че А е равно на константа к Langmuir уравнение.
Изчисляване и р.
Създаване на формулите за изчисляване на височината на адсорбция слой и площта, заета от молекула повърхностно активно вещество върху повърхността на Q разтвор (вж. Фигура 2).
Фиг.2. Устройството за съединение на повърхностно активни молекули в дебелината повърхностен слой.
При насищане адсорбция слой на повърхностно молекули са подредени вертикално, където полярните групи са в разтвор, неполярен група от атоми (радикали) - във въздуха. В областта на S = 1 т2 повърхност са G сърфактант мол / m 2 или G M в кг / м 2, където М - моларен маса на веществото (кг). От друга страна на екрана е S S кг материал където - плътност вещество в кг / м 3 или в кг / м 2. След G M = или
Броят на сърфактантни молекули на 1 м 2 е G NA. където NA - Числото на Авогадро. Вследствие на площта, заета от една молекула е:
Сравнение на изчислената стойност на дебелината на слоя на молекулата дълго известни на неговата структура, е възможно да се заключи, че ориентацията на сърфактантни молекули в адсорбционната слой.
Редът на изпълнение:
Определяне на повърхностното напрежение на повърхностно разтвори се извършва от най-високото налягане на газови мехурчета. този метод на работа се извършва в апарат, конструиран P. A. Rebinderom (Фигура 3).
Съд (1) течност за изпитване (20-50ml) е свързан с манометър вода (2) и капеща фуния (3), който служи за създаване на малък вакуум в системата. Плавателният съд (4) се използва като буфер резервоар. Вакуумната система се осигурява чрез бавно изтичане на вода от делителна фуния (3) в бехерова чаша. Съдът се затваря плътно с гумена запушалка, през която стъклена тръба (5), завършващи в капилярна.
Върхът на капилярна трябва да има гладки остри ръбове. Много удобни типове от дебело стъкло, с разширение pipetkoobraznym предходната капилярна.
Пречистването капилярна всмукване накрайник е направен в него хромова смес с вентилатор, последвано от промиване с дестилирана вода. В експеримент капилярна върха е потопена в течността, но така, че да докосна само на повърхността, леко повишаване на течността (фиг.3.).
Опитът да започне чрез определянето Pmax за дестилирана вода. 6. Отваряне на клапана вътре в съда 1 и вакуумът, създаден чрез течна въздушни мехурчета започват да се изплъзне. балон скорост образуване регулиращ вентил 6 така, че образуването е най-малко 10-20 секунди. на повърхността на балон може да се установи равновесие на адсорбция през това време. При определяне на повърхностното напрежение на границата на течността, съдържаща повърхностно активно вещество, е необходимо по време на образуването на мехурчета не е по-малко от 30 секунди. При превишаване мехурчета забележат разликата в размер нивото на течности (2). Разликата в нивото на течността в размер бн = h2 -H1 на. където h2 - датчик за нивото на течността в лявото коляно; h1 - надясно съответства на максималното налягане, необходимо за образуването на балон Pmax. Промяна на позицията на клапана 6 и повторете измерването Pmax 3-4 пъти и да вземе средната стойност на АН (индивидуални наблюдения колебания не трябва да надвишават 1-2 мм).
По същия начин се извършва измерване разтвор ьН повърхностно активно вещество за 5-6 различни концентрации. Повърхностното напрежение на разтвора изчислява от уравнението (13). Повърхностното напрежение на водата в зависимост от температурата, изчислена по уравнението (7). Експерименталната и изчислени данни се вписват в таблица 1.
Според натрупването таблица 2 адсорбционната изотерма на Т = е (а) и графика на C / T = F (и). Според уравнения (17) и (18) са изчислени стойности на константите на уравнението Langmuir G∞ и к.
CTG G∞ = α = 0.49 / 0.49 * 10 май = 1 х 10 -5 мол / т2
к = 1 / с * G∞ = 1 / 1,2 * 10 5 * 1 * 10 -5 = 0,83 мол / л
Адсорбция изотерма на Т = F (и).

Графика C / T = F (и).
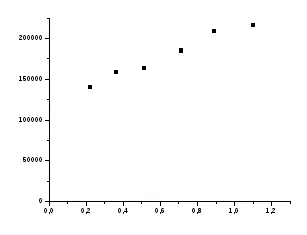
В изотерма на адсорбция подбират няколко точки 5 и се определя стойността на В в уравнение Shishkovsky (21). G∞ очаквате от уравнение (20) и сравни тази стойност със стойността на G∞. изчислена съгласно уравнението Langmuir.
В1 = (0.073 - 0.065) / LN (1.26 / 0.51 - 1) = 0.021 J / т2
В2 = (0.073 - 0.067) / LN (0.9 / 0.4 - 1) = 0.027 J / т2
BSR = (0.021 + 0.027) / 2 = 0.024 J / т2
G∞ = 0.024 / 8.314 * 291 = 9,9 * 10 -6
Изчислената стойност е почти равна на G∞ G∞. Изчислено Langmuir:
Според уравнение (19) преброяване на константа в уравнението Shishkovsky и да гарантира, че А = к в уравнението на Langmuir.
0,073 - 0,060 = 0,024 LN (1 + 0.869 * А)
LN (1 + A * 0,217) = 0.54
0.54 е = 1 + A * 0.869
Изчислената константа е близо по стойност на к, изчислена по уравнението Langmuir:
Според уравнения (22) и (23) напред височина δ на адсорбция слой и площта, заета от молекула повърхностно активно вещество.
Заключение: В повърхностно напрежение на лабораторна работа на етанол разтвори на различни концентрации се определя. Изотерма конструирана σ = е (с). Стойност се изчислява адсорбционната изотерма адсорбция G. конструирана F = F (и). Тази връзка отговаря на Гибс уравнението за такива системи, тъй като зависимостта на C / T = F (в) има линеен характер. Графично, стойностите на константи: адсорбция равновесие константа (К) и на пълна адсорбция насищане повърхност мономолекулен слой адсорбент (G∞). Получените стойности: височина на адсорбция слой и областта на δ р, 1 заета от молекулата на повърхностно активно вещество на повърхността на разтвора.
к = 0.83 мол / л G∞ = 1 * 10-5 мола / m2 δ = 5.77 * 10-4 m Q = 1.68 * 10-19 м2