кръгови процеси
Цикличен процес или цикъл. Този процес се нарича, когато системата преминава през поредица от междинни състояния, той се връща в първоначалното си състояние. Графично цикличен процес е показано на фиг. 6.8 затворена крива състои от удължена част (1А2) и компресия (2Ь1).

За разширяване на газа от тялото до температура Т1. наречено нагревател. Отчетените количество Q1 на топлина. По време на компресията, газът дава топлина количество Q2 от телесната температура Т2 <Т1. называемому холодильником .
Ако цикълът върви в посока на часовниковата стрелка, то се нарича директен. Положителен работа разширение, съставено от газ и числено равна на площта на фигурата (V1 1a2V2), по-голяма отрицателна компресия работа А2. извършва на газ и областта на фигурата, изразено от (V2 2b1V1). Ето защо, работят, за перфектна форма цикъл и числено равна на площта (1a2b1) е положителен:
Директен цикъл се използва в термални машини - периодично действащи устройства, които превръщат топлината, получена от нагревателя, дело на А.
Тъй като в резултат на кръглата процес, системата се рестартира, промяната във вътрешната енергия като функция на държавата, # 916; U = 0.
Следователно, съгласно първия закон на термодинамиката (6.21) за цикличен процес
Предвид това, че Q = Q1 - Q2. имаме:
Определяне на термичен коефициент на ефективност на цикъла като съотношение на работа А за нагряване на получената система:
Независимо дали топлинната ефективност на двигателя, за да бъде равна на 100%?
Цикъл (ris.6.8) може да отиде и обратно на часовниковата стрелка. След това работата му ще бъде отрицателен. Такава цикъл се нарича обратен хладник, и се използва за прехвърляне на vholodilnyh машини (поради операция на външни сили) от топлината на по-висока температура на тялото на телесната температура по-ниска. Процесът на преминаване от състояние 1 до състояние 2 се нарича обратимо. Ако системата се връща към първоначалното състояние на всяка система или в околната среда няма промяна. Всеки процес, който не отговаря на тези условия, се нарича необратим.
Всички реални процеси са необратими. Пример за това е необратимостта на процеса на топлообмен в която топлината се пренася спонтанно от горещата до студената тялото, че може да възникне спонтанно обратния процес.
По този начин, обратими процеси - една идеализирана концепция. Въпреки това, изследването им е важно, защото много от реалните процеси в природата и технологиите в близост до обратими, и те са най-икономични.
Въз основа на втория закон на термодинамиката, Карно се оказа, че от всички топлинни двигатели имат най-висока ефективност на обратима машина. Най-икономичния е цикличен процес, състоящ се от две изотерми и две адиабатно (фигура 6.9), наречен Карно цикъл.
Може да се покаже, че ефективността на цикъл на Карно се определя само от Т1 температури нагревателните и Т2 на хладилника:
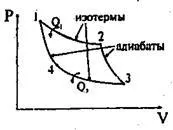
Както следва от (6.47) за да се увеличи # 951; необходимо да се увеличи температурната разлика между Т1 и Т2 на нагревателя на хладилника.
Формули (6,46) и (6,47), следва, че
Като се има предвид, че количеството топлина Q2. подаряват хладилник отрицателно. След последното уравнение може да се запише:
Съотношението Р / Т се нарича намалява топлината.
Намалената топлина предадена нагревател система с безкрайно неговата промяна е # 948; Q / T. Може да се покаже, че за всеки обратим цикличен процес дава количеството топлина на нула. След експресията (6.48) в общата форма може да се изписва като:
Изчезването на интеграла над затворената линия означава, че обратим процес в подинтегрален е общо диференциал на функция S, в зависимост само за състоянието на системата. S е функция на ентропията.
Формула (6,49), който обработва за обратимо изменение в ентропията
Може да се покаже, че необратими nonequilibrium процеси, които протичат в една затворена система, ентропия се увеличава
Отношения (6.51) и (6.52) са комбинирани в неравенството Clausius:
т.е. ентропията на затворена система или се увеличава или остава постоянна.
От реални процеси са необратими, може да се твърди, че всички процеси в една затворена система, водят до увеличаване на ентропията. Това твърдение се нарича принцип на увеличаване на ентропията. Това е още една формулировка на втория закон на термодинамиката.
физичен смисъл на Болцман ентропията на открито, който показа, че ентропията, свързани с термодинамична вероятността за състоянието на системата. В термодинамична вероятността т се определя като броя на начините, по които могат да бъдат приложени дадено състояние на системата. Според Болцман, връзката S и W се изчислява по формулата:
където к - е постоянна Болцман.
Когато достигне равновесната състоянието на системата в това състояние, системата може да остане за неопределено време, т.е. системни параметри не се променят и няма система на енергийните потоци или вещество. Ако потоци се провеждат, промяната във вътрешната енергия Du може да се случи не само поради съобщенията за топлоотвеждане # 948; Q и направи над работата си # 948 А, но също така и чрез трансфер на маса. След първия закон на термодинамиката може да се запише в по-общ вид
DU = # 948; Q - PDV + # 956; DN,
където нарича химически потенциалната енергия на системата и представлява промяна на частиците, които участват в предаването когато V = конст и S = конст.
Наречена фаза термодинамично равновесие състояние на материята отличава не по химичен състав и други физични свойства на равновесните състояния на същото вещество (например, вода може да бъде в три фази: течна, твърда и пара форма). Преход на вещество от една фаза към друга се нарича преход фаза.
Разграничаване фазови преходи I и тип II. преход Фаза I вид, свързан с абсорбция или освобождаване на топлина (например, топене и кристализация). Фазов преход род II не са свързани с топлина (например, превръщане на някои материали в определени температури на свръхпроводящ състояние см. Точка 5.7).
състояние диаграма използва за характеризиране на фазови преходи (обикновено координира P - Т). В тези схеми, може да се намери точка на равновесие на едновременни три фази - тройната точка. Например, тройната точка на водата 273.16 К. термодинамика позволява да се изчисли равновесие на двете фази на един материал, като се използва Clapeyron - Clausius:
,
където производното на температурата на равновесие налягане зависи от топлината на фазовия преход # 955; температура на преход и промяна на обема на фаза (например, когато водата замръзва своите увеличения обем).