Класификация на сложни реакции
Повечето от химични реакции, настъпили в света около нас и да се използва в индустрията са сложни. В зависимост от механизма, те са разделени на обратима, паралелен, сериен, конюгат, верига.
За обратими реакции са, че при дадените условия може да възникне спонтанно както в права и обратна посока. Като цяло, обратима реакция химическа формула е написано, както следва:
където а, б, в, г, .... - стехиометрични коефициенти на източника на формули (А, В, ....) и окончателно (С, D, ...) вещества.
Един пример на обратим процес срещащи се в живите организми, може да служи като реакция на естерификация:
както се използва в индустрията - синтеза на амоняк от азот и водород:
Скоростта на обратима реакция е разликата между курсовете на предна и задна реакции.
Паралелни реакции се наричат реакция тип:
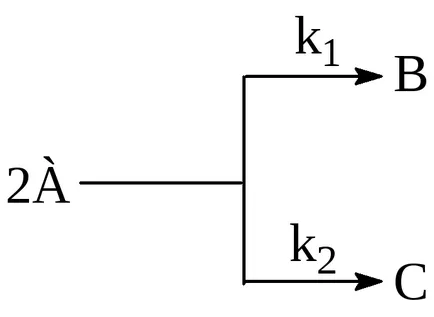
т.е. в който същите изходни материали, докато взаимодействие една с друга за образуване на различни продукти.
Един пример на този тип реакция е реакция разлагане KClO3 хлорат сол. способна да тече при определени условия в две посоки
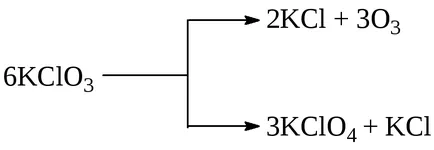
Успоредно с това, два или повече механизми могат да се вливат гниене на атомните ядра на някои радиоактивни елементи. Много често паралелни реакции възникват в органичната химия. Например, ако сулфонирането на толуен сярна киселина може да бъде едновременно образува орто- и parasulfoproizvodnye:
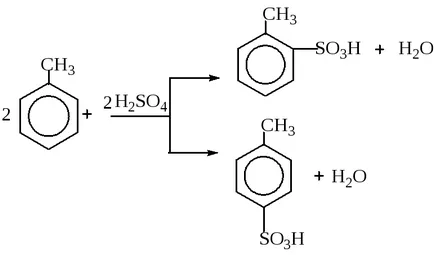
В някои случаи, може да бъде успоредни и биохимични реакции в клетките на живите организми. Например, ензимната ферментация на глюкоза:
1) С6 Н12 О6
2) С6 Н12 О6
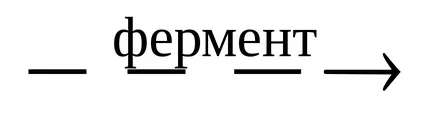
При определени условия, може да се появят много паралелни реакции главно само в една посока.
успоредно скорост на реакцията се определя от най-бързо етап скорост.
Са тези последователни реакции, в които образуването на крайния продукт от изходните материали не е пряко и задължително през няколко междинни етапи, които се извършват една след друга в строго определена последователност. Схематично, този процес може да се опише както следва:
където всяка буква означава отделен етап. По принцип броят на етапи в последователни реакции могат да бъдат много различни (от няколко до няколко десетки). Освен това, всеки от етапите, от своя страна, не е непременно прост моно- или бимолекулярен реакция, но може да бъде трудно.
Поред реакции са много често срещани в природата и много често те се наблюдава в биохимичните процеси, протичащи в живите организми, растения. Като примери за такива реакции могат да причинят фотосинтеза и биологично окисление на глюкоза, хидролиза на олиго- и полизахариди, и т.н.
Изчисляване на кинетиката на последователни реакции е много сложна и доста точно може да се прилага за относително прост процес, състоящ се от малък брой стъпки.
Въпреки това, ако един от етапите на последователни реакционни има значително по-ниска скорост, отколкото останалата част, като цяло скоростта на реакцията се определя от скоростта на този етап, което в този случай nazyvaetsyalimitiruyuschey.
Например, реакцията на хлориране на азотния оксид (II)
Тя се състои от два етапа:
2) NOCl2 + NO = 2NOCl
Първият етап е бърза и образуване на нестабилни NOCl2 продукт. Вторият етап е бавен и ограничаващи. през скоростта на реакцията е описан от кинетичен уравнение
и общата процедура за тази реакция е 2.
Конюгат посочена реакции протичат по следната схема:
Един от тези реакции могат да се появят след независимо и втората реакция е възможно само в присъствието на първия. Така потокът на една реакция започва вторият вариант.
Конюгат възможно реакция в биохимията. Те се срещат в клетките, с енергията, необходима за протичане на втора реакция с ΔG2> 0, дава първата реакция, за които ΔG1 <0. Причём │ΔG1 │> │ΔG2 │, т.е. целият процес се осъществява с намаляване на Гибс енергия. Тези биохимични реакции се наричат inachetandemnymi.
Често механизъм конюгатни реакции е образуване на активни междинни частици, които са отговорни за тяхната поява.
Верига свързан реакции от този тип могат да бъдат обикновено представени, както следва:
където С - активни междинни частици.
Например, бензен във воден разтвор на Н 2О 2 не се окислява. но при добавяне на железен сол е неговото превръщане в фенол и дифенил. С цел да се "започне процеса ionyFe 2+ първо реагира с H2 O2. образуващи радикали · ОН
които след това се привежда във взаимодействие с бензол като
Fe2 + + ∙ ОН → Fe3 + + OH -
Феноменът на химическа индукция първо се изследва чрез NA Shilov 1905
Верига наречен химични реакции протичат през серия от редовно повтаряне елементарни стъпки, включващи активни видове, съдържащи в състава си атоми с несдвоени електрони в нивото на външната енергия (или някои други - свободни радикали).
К верига са реакции горене на полимеризация и поликондензация гниене на ядра и други.
Механизмът на верижни реакции е, че свободни радикали (често в тяхната роля стърчат единични атома) имат висока химическа активност. Те лесно реагира със стабилни молекули и ги превръщат в активни частици, които след това образуват реакционни продукти и нови радикали и по този начин има верига на по-нататъшни стъпки. Реакцията на веригата продължава докато всички вещество взаимодейства или докато няма активни частици радикали.
За верижни реакции се характеризират с три фази: 1) ядрено верига; 2) развитие на верига или височината й; 3) отворена верига.
Limbo верига започва с елементарен химически действие, което води до образуване на активни частици. Този процес изисква енергия и може да бъде вещество при нагряване, излагане на йонизираща радиация, действието на катализатора.
Например, в реакцията на синтез на хлороводород и хлор и водород, преминаващ през механизъм верига (Н2 + Cl2 = 2HCl) верига съответства на появата на процеса
верига развитие е периодично повторение на реакционни етапи, с образуваните радикали. Те са известни още като верижни елементи:
Дължината на веригата определя от броя на молекулите на изходния материал взаимодейства в един акт от ядрено верига, преди прекратяването му.
Особеностите на етапа на развитие на верижни реакции са разделени в неразклонен irazvetvlonnye. В първия случай, количеството на свободни активни частици радикали остава постоянна по време на тази фаза.
Реакциите на разклонена верига вливат един активни частици води до образуването на други активни частици (многократно две или повече). Схематично може да бъде представен, както следва:
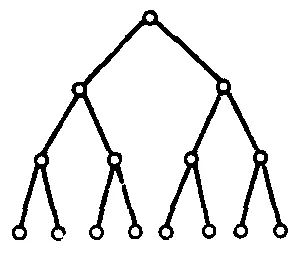
Open верига съответства на изчезването на активните видове в резултат на тяхното взаимодействие една с друга:
Освен това може да се случи при адсорбционни стените на съдовете частици при сблъсък на двата активни частици с третия (наречена инхибитор), където активните видове се дава на повече енергия. Следователно, за верижни реакции типично зависимост от скоростта на размера, формата и материалът на реакционния съд, наличието на странични инертни вещества, които действат като инхибитор.
Скорост реакции неразклонена верига определя от скоростта на бавния етап, т.е. раждането на веригата. За всяка стъпка в реакции от този тип се използват конвенционални химически кинетика уравнения (първи или втори ред).
Разклонена химически реакции могат да се появят в комплекс кинетичната закона и не разполагат с конкретна цел. "Размножаване" радикали него често води до каскада от процес поток, което причинява експлозия. Въпреки това, в тези реакции е възможно недостатъчност верига. Ето защо, по-бързо увеличаване на скоростта на процеса (до експлозия), ако лихвата разклоняване, темпо oprezhaet неговото счупване. Теорията на верижни реакции е разработен произведения на акад NN Семьонов, SN Hinshelwood (Англия), и др. Учените.
Има верижна реакция, в която ролята на активните частици не стърчат радикали и йони, получени от хетеролитична разграждат химична връзка:
Такъв механизъм е на практика често се осъществява в полимеризационни реакции на ненаситени органични съединения.