карбоксилна група
Той съдържа съседни първични алкохолни и кетонни групи.
Тъй електрони възникващите интерфейс система, -ketolnaya група притежава силни редуциращи свойства (по-силни, отколкото конвенционалните първични алкохоли и кетони). Окисленият същите реактиви като алдехиди (виж "Алдехиди", п 1 ..) постъпления окисляване съгласно схемата:
Примери LOS съдържащи -ketolnuyu група: кортизон, хидрокортизон, дезоксикортикостерон, преднизон, и др.
1. киселина-основа. Карбоксилната група проявява доста силни киселинни свойства. киселина рКа от около 4.7-4.8. Дължината на радикал има почти никакъв ефект върху силата на киселинни свойства. Въвеждане въглеводороден радикал или цикъл електрон-отнемане заместители (халогени, хидроксилна група, нитро група, карбоксилна група, по-) значително увеличава (1 - 2 - 3 рКа единици) киселинна карбоксилна група.
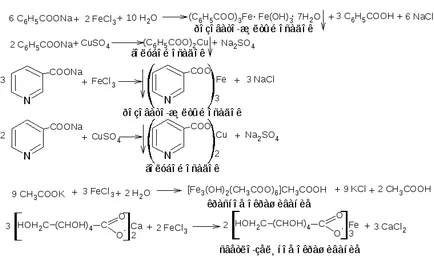
В разтвор, карбоксилната група се подлага на йонизация, образува карбоксилат йон (анион на съответната киселина) и протон. Карбоксилат йон показва основните свойства (слаба основа). Карбоксилни киселини образуват сол чрез взаимодействие с хидроксиди, карбонати и бикарбонати на алкални метали (натрий и калий) и амониеви соли. Тези соли обикновено са лесно разтворими във вода, са безцветни. Карбоксилната група под формата на анион (например като сол) взаимодейства със соли на тежки метали (мед, желязо, кобалт). Ефектът на реакцията - образуването на слабо разтворими соли във вода. цвят Боядисване се определя от лекарството и реагент. Медни соли са оцветени в синьо-зелен, желязо - жълто-розово, кобалт - в розово.
2.Eterifikatsiya с алкохоли (вж. "Алкохолни хидроксил", стр.1).
реакция удостоверяване
1. Реакцията на образуване на естери (естерификация).
Методика. За 0,02гр на лекарствената субстанция (ацетат, калиев бензоена киселина, ацетилсалицилова киселина, никотинова киселина) се поставя в суха флакон се прибавят 2 капки 95% алкохол, 5 капки концентрирана сярна киселина и сместа се нагрява внимателно; Чувствах миризма естери.
2. Реакциите с тежки метални соли.
Характеристики на реакциите:
Лекарствено вещество реагира само в йонизирана форма, така че първо се превръща в натриев (или амониев) сол. Реакционната среда трябва да бъде близо до неутрално, така че алкален се разтваря в еквивалентно количество (не излишък). В алкална среда реактиви утаяват като хидроксиди с лекарственото вещество не реагират.
Реакциите на тази група са чувствителни, така че е необходимо да се получи концентриран разтвор на лекарството (обикновено 2-5%).
Методика. 2.1. За 0,15гр на лекарството (бензоена киселина, никотинова киселина) се разклаща с 3 мл разтвор на натриев хидроксид (0,1 мол \ L), филтрира (филтратът може да се добави 1-2 мл вода). Филтратът се разделя на две части. Първата част се прибавя 2 капки разтвор на железен (III) хлорид, във втората - 2 капки разтвор на меден (II) сулфат; наблюдаваната реакция ефект.
2.2. За 0.05 грама на лекарствената субстанция (калиев ацетат, калциев глюконат) се разтваря в 2 мл вода, разтворът се разделя на две части. Реакцията се провежда с горните реагенти, се наблюдава ефект на реакцията.
количествено определяне
1.Alkalimetrichesky метод неутрализация. Въз основа на свойствата на силна киселина карбоксилна група. Титрант - разтвор на натриев хидроксид. - индикатор фенолфталеин (рН цвят преход гама 8,2- 10,0 следователно подходящ за титруване на карбоксилни киселини). водонеразтворими лекарства предварително разтворен в органичен разтворител (етилов алкохол, най-малко - ацетон).
fekv (салицилова киселина) = 1
2. Определяне на натриеви и калиеви соли на карбоксилни киселини.
Карбоксилат йон проявява слаби основни свойства, така че използва ацидиметрично метод. Водният разтвор се титрува трудно.
2.1. Методът на ацидиметрия в среда Protogenov разтваря
erator. засилване слаби основни свойства на карбоксилат йон. Разтворителят е ледена титрант оцетна киселина - разтвор на перхлорна киселина в ледена оцетна киселина, индикатор - разтвор кристал виолет в ледена оцетна киселина.
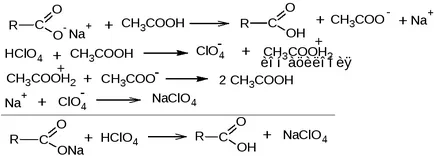
fekv (вещество) = 1 / п, където п - брой на карбоксилатни йони във веществото.
2.2. Ацидиметрично метод неутрализация (изместване). Използва за определяне на соли на карбоксилни киселини в съставите, получени непосредствено преди употреба. Титрант - солна киселина. показатели PH с цвят преход интервал от около 2 (синьо тимол, диметил жълто). В титруването в присъствието на метил оранжево (рН 3.0 - 4.4) трябва да се прибавя етер, което извлича получената карбоксилна киселина, и по този начин измества реакцията на равновесие надясно.
fekv (натриев салицилат) = 1
(РКа 2.89; рН 3 се титрува само 50% от съединението, киселина екстракт салицилова, което да се постигне почти 100% Превръщането на солта на киселината).