Кало - Безплатни онлайн енциклопедия - Енциклопедия & речник
Кало (от латинската CALOR -.. Топлина и метър)
устройство за измерване на количеството топлина, освободено или абсорбира в физически, химичен или биологичен процес. Терминът "К" е предложен от Лавоазие и Лаплас, P. (1780).
К. Modern работи в температурен диапазон от 0.1 до 3500 К и се оставя да се измери количеството топлина до 10 2%. К. Апаратът е много гъвкава и зависи от естеството и продължителността на процеса на изследване, регион температура в които са направени измерванията, количеството топлина се измерва и изисква точност.
К. предназначен за измерване на общото количество топлина Q. освободен по време на това от началото до края се нарича К. интегратор; К. измерване на топлинна енергия L и промени своите на различни етапи - на електромера или K-осцилоскоп. Чрез изграждане, системата за измерване калориметър и метод разлика между течност и масивна К. единична и двойна (диференциална).
Течен К. интегратор променлива температура (фиг. 1), за да изотермични обвивка се използва за измерване на топлина на разтваряне и топлината на химични реакции. Той се състои от съд с течност (обикновено вода), които са: камерата за провеждане на процеса на тест ( "бомба калориметър"), бъркалка, нагревател и термометър. Топлината, освободена в камерата, след това разпределена между камерата и друг флуид. К. части, които заедно се наричат калориметър система инструмент. Промяната в състояние (например, температура) калориметричен система измерва количеството топлина, въведена в К. Отоплителната система е фиксиран калориметър термометър. Преди измерванията се калибрира К. - определяне на промяната на температурата на системата за калориметър чрез придаване на определено количество топлина (К. нагревател или в резултат на химична реакция камера с известно количество стандартна субстанция). В резултат на калибриране стойност К съдържа получаване на топлинна т. Е. коефициент, който трябва да бъде умножена на измерената температура промяна К. термометър за определяне на количеството топлина постави в него. Термичната стойността на к е калориметричен системата за топлинен капацитет (в). . Определяне на неизвестно топлината на изгаряне или химична реакция, и т.н. Q намалява до промяна на температурата АТ система калориметричен измерване причинени от процес изследвани: Q = С .Δt. Обикновено Q стойност по теглото на вещество, съдържащо се в камерата К.
Калориметрични измервания позволяват директно да се определи само количеството топлина на процеса на изпитване и различни вторични процеси, като например разбъркване, изпаряване на водата, с ампула разчупването на вещество, и т.н. Heat странични процеси трябва да бъдат определени от експеримент или изчисление и изключени от крайния резултат. Един от методите е неизбежно страна К. топлина трансфер с околната среда от радиация и проводимост. В ред счетоводна странични процеси предимно система за обмен на топлина калориметричен съраунд обвивка, чиято температура се контролира.
В изотермична температура на течността К. обвивка се поддържа постоянна. При определяне на химическата реакция нагрява най-големите трудности често свързани с не се вземат под внимание вторични процеси, и определянето на пълнота на реакцията и на необходимостта да се вземат предвид няколко реакции.
VK-интегратор друг вид - изотермично (постоянна температура) влезе горе топлината не се променя температурата на калориметричната система и причинява промяна в общия състояние на организма, който е част от системата (например, топене на лед в лед Бунзенова калориметър). Броят на въведения топлината се изчислява в този случай от теглото вещество, което променя състоянието на агрегация (например, тегло на разтопения лед, която може да бъде измерена чрез промяна на обема смес от лед и вода), и се загрява на фазов преход (вж. Топлината на фазов преход).
Мащабна К. интегратор най-често се използва за определяне на енталпията (Вж. Енталпия) на материали при високи температури (2500 ° С). К. калориметър система от този тип е блок от метал (обикновено мед или алуминий) с вдлъбнатини за съда, в който реакцията протича, термометър и нагревател. Енталпията на веществото се изчислява като продукта от топлинна стойност К чрез разликата в температурата изкачвания блок измерва след отпадането в контакта с определено количество ампули вещество и след това празната ампулата, загрява се до същата температура.
газове топлинен капацитет, а понякога и течности, определена в т. N. К. лабиринт поток - от разликата в температурата на входа и изхода на флуидния поток или стационарен газов поток, и силата на Джаул топлината, специален електрически нагревател К.
К. действа като електромера, за разлика от K-интегратор трябва да има значителен пренос на топлина за въвеждане на количеството топлина бързо отстранени и състоянието на К определя от моментната стойност на мощността на топлинната процес. Термично мощност е процеса на топлообмен с черупката K. Такова К. (фиг. 2), разработен от френски физика Е. Calve (Ye Calvet, 1895-1966), е метален блок с канали, които са поставени в цилиндричен клетката. В клетката, процесът на изследване се провежда; метален блок играе ролята на черупката (температурата се поддържа постоянна с точност от 10 -5 -10 -6 K). Температурната разлика измерва чрез единична клетка и термоелектрически като 1000 възли. Топлообмен клетка едн и малък термоелектрически е пропорционална на температурната разлика срещащи между устройството и клетката, когато топлината, освободена или абсорбира в нея. Блокът се поставя предимно две клетки, действащи като диференциален термоелектрически К. всяка клетка има същия брой възли и следователно тяхната разлика позволява едн директно определяне на разликата между потоците на топлинен капацитет, въведени в клетката. Този метод избягва изкривяване измервания измерваната случайни флуктуации блокират температура. Всяка клетка обикновено монтирани две термоелектрически: позволява да се компенсира топлинната мощност на процеса на тест на базата на ефекта на Пелтие, и от друга страна (индикатор) се използва за измерване на некомпенсирано част на топлинния поток. В този случай, устройството работи като диференциална компенсация К. При стайна температура, като топлинен капацитет К. измерва процеси до 1 MW.
Конвенционални име К. - "химична реакция", "бомба", "изотермични", "лед", "ниска температура" - са на исторически произход и точка предимно на метода и обхвата на използване К. са нито пълна, нито тяхното сравнителна характеристика ,
К. обща класификация могат да се изграждат на базата на разглеждането на трите основни променливи, които определят начина на измерване: колориметричен Tc температурата на системата; До температурата на обвивката. Environmental калориметричен система L. количество топлина освобождава в К. за единица време (топлинен капацитет).
В. с постоянен Tc и да се обадя изотермични; с Tc = To - адиабатно; С работа при постоянна температура разлика Tc - Да. нарича K с постоянен пренос на топлина; в isoperibolic К. (това се нарича К. изотермични обвивка) е постоянно да. и Тс е функция на топлинен капацитет L.
Важен фактор, който влияе на крайния резултат от измерванията е надеждна работа на автоматичното регулиране на температурата изотермични или адиабатни черупки. В адиабатно температурата на обвивката на К. се регулира така, че да е винаги близо до температурата на смяна на системата топломер. Адиабатичната обвивка - лек метален екран, снабден с нагревател - намалява преноса на топлина, така че К. температура варира от само няколко десет хилядни от градуса / минута. тя често намалява топлообмена при калориметричната експериментът да незначителна стойност, която може да бъде пренебрегната. Ако е необходимо, резултатите от преки измервания се коригират на обмен на топлина, метода на изчисление, който се основава на закона на топлопреминаване на Нютон - пропорционалност на топлинния поток между К и обвивка разлика от тяхната температура, ако разликата е малка (до 3-4 ° С).
К. За изотермични обвивка топлина на химическа реакция може да бъде определена с точност до 0,01%. Ако размерите К. малък, температурата варира повече от 2-3 ° С и процеса на наблюдение е дълъг, след изотермични корекция на плик за топлообмен може да достигне 15-20% от измерената стойност и силно ограничава точността на измерванията. В тези случаи е по-целесъобразно да се използва адиабатен черупка.
С адиабатно К. определяне на специфичната топлина на твърди и течни вещества в границите от 0.1 до 1000 К. При стайна температура и по-ниска адиабатно К. защитен кожух вакуум се потапя в дюаровия съд (Вж. Dewar), напълнена с течен хелий, водород или азот (фиг. 3). При повишени температури (над 100 ° С) се поставя в термостатна К. електрическа пещ.
Лит. Popov М. М. Термометрия и калориметрия, 2-ро издание. Москва, 1954; Skuratov SM Kolosov VP Vorobev A. F. термохимия, 1-2 часа, М. 1964-66 .; Calvet Е. A. Prat Микро-калориметрия, транс. с Франция. М. 1963; Експериментална термохимия, кн. 1-2 N. Y. - L. 1956-62.
Фиг. 1. Течен калориметър интегратор с изотермично черупка (схема): 1 - "бомба калориметър"; 2 - нагревател за възбуждане на реакцията; 3 - всъщност калориметър (съд, пълен с вода); 4 - устойчивост термометър; 5 - хладилник (тръбата, през която може да премине студен въздух); 6 - изотермично калориметър обвивка пълни с вода; 7 - нагревател обвивка; 8 - контакт термометър за обвивка регулиране на температурата; 9 - контрол термометър; 10 - с механична бъркалка.
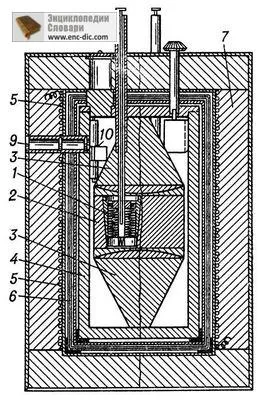
Фиг. 2. Е. Calvet калориметър за измерване на топлинна енергия процеси (схема) 1 - калориметричен клетка с термодвойки; 2 - калориметър блок; 3 - метални конуси за създаване на равномерна температура поле в блока; 4 - обвивка; 5 - нагревател за контрол на температурата устройство; 6 - топлинни щитове; 7 - топлоизолация; 8 - тръбата за въвеждане на вещество в калориметъра; 9 - прозорец за вземане на проби галванометричните 10.
Фиг. 3. адиабатичната калориметър за определяне на топлинния капацитет при ниски температури (схема) 1 - калориметър (а - съд за веществото, - термометър резистентност, в - нагревател); 2 - адиабатно черупка (екран); 3 - вакуум изолация; 4 - тръба за изпомпване; 5 - тръба за електрически проводници.
Голяма съветска енциклопедия. - М. съветски Енциклопедия 1969-1978