Какво е афинитетна хроматография, афинитетна хроматография видове
Афинитетна хроматография - един вид на адсорбционна хроматография. Главната особеност е наличието на афинитетна хроматография на допълване между имобилизиран лиганд на матрицата и втори партньор двойка взаимодействащи компоненти, които се извличат от смес с други вещества, които не комплементарна лиганд. Използването на високо селективен взаимодействие позволява един етап да се постигне много висока степен на пречистване на желания вещество. Affine взаимодействие е нековалентно и могат да бъдат облекчени чрез промяна на рН, йонната сила, се въвежда разтвор на вещества, които предотвратяват образуването на допълнителни връзки. Важни предимства на афинитетна хроматография са: висока селективност, ефектът на концентрация на вещество в матрица афинитет и освобождаването на хидролитични ензими. Афинитетно пречистване може често да запази нативната структура veschestva.Chasche цялата лиганд е ковалентно имобилизиран върху матрица. За да се определи лиганд матрица трябва да бъдат предварително активирани, т.е., на повърхността на частиците на носителя трябва да бъдат създадени реактивни групи. Най-често срещаният метод на активиране - създаване на повърхността на матрицата на електрофилни групи, способни да реагират с нуклеофилни групи на лиганда. Процесът на имобилизиране лиганд намалява до инкубиране му с активирания матрикс. Трябва да се отбележи, че скоростта на реакцията силно зависи от рН на средата. В имунохимия използва като матрица за обездвижване на антиген или антитяло, прикрепени към матрицата. Движение афинитетна хроматография, при което като имобилизиран лиганд антитяло, използвано е известен като имуноафинитетна хроматография.
Един от най-често срещаните медии, използвани в биохимията през последните няколко десетилетия, а Sepharose - специално обработен сферични топчета с агароза. Има няколко начина, за да активирате Sepharose, но методът на които се използва активация по-често, отколкото други сефарозни с цианогенбромид (BrCN). Предимството на този метод е неговата простота, висока устойчивост образува връзки стабилен сефароза в доста широк диапазон на рН (2.0 до 12.0). Относителната твърдостта и големи размери на частиците Sepharose позволяват използването на такива среди в колона хроматография при относително високи скорости на захранване на решения в колоната.
Активирането на инкубиране Sepharose се провежда в разтвор с водна суспензия от цианоген бромид сефароза. Цианоген бромид взаимодейства с хидроксилни групи на Сефарозата да образуват imidokarbonat съдържащ електрофилен въглероден атом. Освен това по време на реакцията се получава карбамат неактивен, не е способен на взаимодействие с нуклеофилна амино киселина странични групи. Чрез взаимодействие с нуклеофилни групи imidokarbonata предимно с лизин е-амино групи, образуването на силна ковалентна протеин поради матрицата чрез активиран изоуреа остатък или N-заместен карбамат (фиг. 1). Реакция с цианоген бромид активиране на матрицата се простира само в алкална среда с отделяне на бромоводородна киселина за неутрализиране, което изисква непрекъснато добавяне на алкален към реакционната смес. Реакцията на цианоген бромид с хидроксил матрица е екзотермична, така че се извършва в ледена баня.
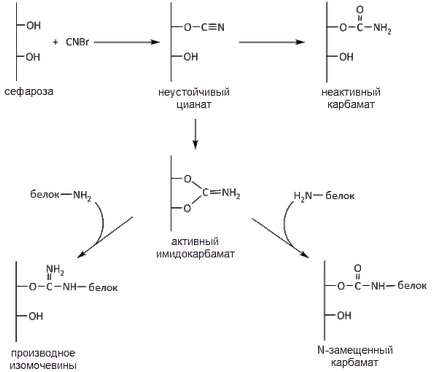
Фиг. 1. Схема протеин обездвижване на BrCN-активирана сефароза
Трябва да се отбележи, че активните нуклеофили освен д-амино групи на лизин са също SH-група на цистеин и крайните аминогрупи на протеин тирозин ОН група (за дейността групи данни са подредени в следния ред: групи SH- ˃ терминал NH2 - ˃ ОН-група на тирозин) , От друга страна, тиоетери малко трайни от кислородни етери и последната отстъпва на силата на амидна връзка.
На имунохимични проучвания, използващи BrCN-активирана сефароза получават два вида носители - носители с имобилизирани антигени и медиите с имобилизирани антитела. Първият има ограничено приложение и обикновено се използва за изолиране на имунен животински серум (съдържащ антитела с различни специфичности) антитяло басейн специфичен само към протеина имобилизирано върху подложката. Много по-често, на практика, превозвачите с обездвижени антитела. Основните приложения на такива носители - екстракция на груби смеси от макромолекули (обикновено - протеини). Високата специфичност на антитяло към антигена позволява кратко време и в един етап да се получи с висока чистота (с чистота до 95-99%) на протеин лекарство.

Фиг. 2. Инсталация за имуноафинитетна хроматографска колона
Екстракцията на протеина при изследване се извършва по два начина от сместа. Произход използва обикновено за получаване на препаративни количества протеин, на базата на метода на имуноафинитетна хроматография колона (Фигура 2). В зависимост от колоната задача на афинитет носител изпълнен с различни диаметри (от няколко милиметра до м) и се пропуска през тези колони протеинов разтвор, съдържащ антигена под изследване. Повечето макромолекулни носещи частици преминава през без спиране, докато между антителата, имобилизирани върху носителя и антиген се съдържа в разтвор, имунен комплекс се образува (фиг. 3). След промиване на съдействието от несвързани протеини имунен комплекс се разлага чрез преминаване през ниско разтвор на носител (рН 2,0 - рН 4,0) или висока (рН 11,0 - рН 12,0) стойности на рН, или разтвори с висока йонна сила (2М NaCl), или разтвори, съдържащи хаотропен съединение (KSCN). В този случай целевия протеин се елуира от носителя, се събира и се прехвърля в оптималното съхранение на протеин буфер.
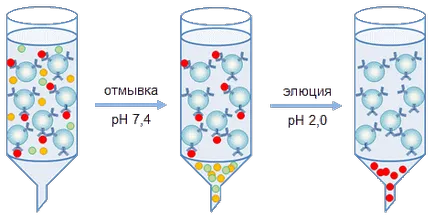
Фиг. 3. Схема хроматография на протеини на афинитет среда на.
Вторият метод за екстракция на тест протеин от сложна смес - имунопреципитация, или екстракция в обем. Имунопреципитация се използва при работа с малки (нано- и микрограма) количества от веществото. Обемът на носителя на афинитет е обикновено по-малко от сто микролитра, и обема на пробата за изпитване - няколко милилитра. Това е, имунопреципитация се използва в случаите, когато поради малкия размер на веществото е технически трудно да се създаде адекватна колона размер афинитет.
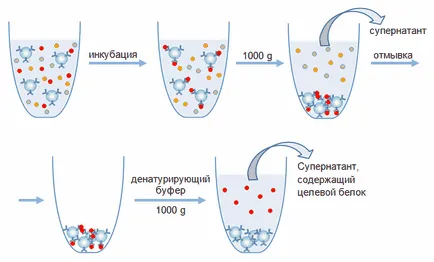
Фиг. 4. изолирането на схема афинитет на протеини чрез имунопреципитация.
При провеждането на имунопреципитация проба, съдържаща прицелния протеин, се инкубира в продължение на известно време (при постоянно разбъркване) с носещи частици. По време на инкубирането, имунен комплекс се образува, и целевия протеин протича от разтвора върху частиците на носителя. След това, подложката се утаява, обикновено чрез центрофугиране, супернатантата се отстранява, и имунният комплекс имобилизиран върху частиците на носителя разрушени чрез прибавяне на същите разтвори както в случая с колонна хроматография (фиг. 4). Също така, имунният комплекс може да бъде разрушена от SDS-съдържащ буфер, който се използва за получаване на проба протеин при SDS електрофореза. Този буфер се използва в случай, че по-нататъшно проучване план екстрахира протеин като се използва метода на електрофореза в условия на денатуриране, или чрез Western блотинг. Въпреки това, когато се използва този метод, протеин елуиране следва да се отбележи, че носител повторна употреба става невъзможно поради денатуриране на имобилизираните антитела. В допълнение, на пробата, в допълнение към протеина мишена ще съдържа леки и тежки вериги на имуноглобулини.