Излъчване и поглъщане на енергия от атоми и молекули - studopediya
През 1913 г. Бор предложи теория на излъчване на светлина, която се основава на два постулата:
1. вътрешната енергия е дискретни атома, т.е. може да получи само някои позволени стойности или нива, които са кратни на характерните количества за даден атом, или кванти енергия. Стоейки атом, съответстващи на тези енергийни нива са стационарни: в това състояние, атомът излъчва електромагнитни вълни, възникващи независимо от движението на електроните в него.
2. емисия (или усвояване) на електромагнитно излъчване се среща в преход атом от един стабилно състояние в друго. По този начин, излъчвана (или абсорбира) монохромни радиация с енергия един фотон, равна на разликата между енергиите Ем и Ен на енергийните нива:
където Ем и Ен - енергийна система в първата и втората страни, з - константата на Планк, п - честотата на излъчваната вълна ..
Въз основа на тези постулати Бор разработена теория на радиация и абсорбция на светлинна енергия водороден атом. Предполага се, че всички възможни електронни орбити извършват само тези, за които моментът на импулса (ъглов момент) е равна на цяло число, кратно на константата на Планк разделена от 2p:
Най-н номер. Той нарече главен квантовата брой съответства на броя orbity.v - електрон скорост в стационарна орбита.
В случай на водороден атом Кулон силата на привличане на протона и електрона е центростремителна сила, която държи електрони в орбита, която е:
където т и д - електронен маса и заряд, R - радиусът на орбитата.
Премахването обем от (1.1) и (1.2), ние откриваме, че радиусът на електронните орбити в атом може да отнеме само няколко дискретни стойности:
(1) е заместен в (1.2), където. (N = 1, 2, 3).
По този начин, радиусите на стационарни орбитите на водородния атом пряко пропорционална на квадрата на квантовата броя N2.
За първите основни орбитите п = 1 и радиус.
От горните отношения и се електрон скорост на орбита. За основните орбитите на водородния атом (п = 1): 2,3 х 10 август см / сек. Това е от порядъка на скоростта на електрон орбита.
Нивото на енергия от атоми, причинени общата енергия на електрона, който се състои от електронен кинетичната енергия (неподвижна сърцевина) на електронна енергия и взаимодействието с ядрото (потенциална енергия). Потенциалната енергия на електрона (знакът е отрицателен, тъй като потенциалната енергия на силите на привличане) е равен на:
Завършването на вътрешния енергиен:
По този начин, електронна енергия, свързан с ядрото на атом, е отрицателен. свободен електрон енергия е равна на нула.
Заместването на изразяване стойността на скоростта на електрони, намираме:
Следващите стойности се получават за водородния атом:
основния (нула) ниво, п = 1, Е1 = - 13.55 ЕГ;
Схемата за енергийно ниво на водородния атом е показано на фиг.

Фиг. 1.1. Структура на енергийните нива на водородния атом.
Тъй като енергийните нива са обратно пропорционална на квадрата на квантовата числото п 2. разликата между всеки две съседни слоеве, тъй като броят и намалява абсолютна стойност. По този начин, като разстоянието от разликата в ядро между две съседни енергийни нива на атома намалява:
Редовен най-ниското ниво на енергия се нарича първично, то съответства на състоянието на атома, е бил подложен на никакви външни влияния. Останалите стационарни нива се наричат развълнувани.
Възбуждане атом, т.е. електронен трансфер в орбита по-голям радиус (фиг. 1.1. Възел 1) изисква съобщения атом допълнителна енергия и следователно да възникнат в резултат на външни влияния, като сблъсък на частици в процес на интензивно движение или топлинна един газов разряд, при абсорбиране на фотон на електромагнитно излъчване, в резултат от рекомбинация на газови йони или електрони и дупки в полупроводника, когато са изложени на радиация частици атом, и т.н. В възбудено състояние е нестабилен след около 10 сек -8 електрони се връща към основната орбита, излъчваната фотон разпенващ допълнителна енергия, получена при възбуждане и атом отива към основното състояние (Fig.1.1. 2 преход).
Електрон да се върнете към основната орбитата на не само една промяна, но също така стъпки през междинните нива. В този случай, преходът ще бъде няколко фотони излъчвани (фиг. 1.1. 3 изместване) с честоти, съответстващи на енергия разликата между тези нива.
теория Бор обяснено сериен модели спектър от водородни атоми и водородни атоми. По това време на теорията е триумф за развитието на ядрената физика. Въпреки това, тази теория не обяснява разликите в интензитета на спектралните линии, не се разкрива законите на по-сложни атоми. Основният недостатък на теорията - нейната несъответствието. Той съчетава ситуацията коренно различни теории на класическата и квантовата. Така, съгласно теорията на електрон движи по кръгова орбита около ядрото, което съответства на концепциите на класическата физика. По-късно, теория на Бор е заменен с квантовата механика.
Зависимостта на излъчената енергия от атоми или молекули на дължината на вълната или честотата на светлина вълна се нарича спектър на излъчване. и абсорбира - абсорбционен спектър. Интензитетът на спектралните линии определят от броя на идентичните преходи срещащи за единица време, и следователно зависи от броя на излъчване (абсорбиращи) атоми и съответния преход вероятността.
Атомните спектри наречени като спектрите на емисиите и спектрите на абсорбция, които възникват при преходите между квантовата нива на свободен или слабо взаимодействащи атома. Атомни спектри са управлявали.
Под оптични атомните спектри разбрано от тези, които са причинени от прехода между нива на външните електрони от фотонна енергия от порядъка на няколко електронволта. Това включва UV, видими и близо IR (микрона до) спектър. спектър на емисиите на водородния атом са няколко серии. Всяка серия съответства на преходи от различните нива в същото края.
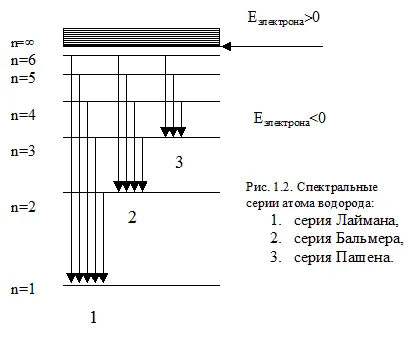
Спектралните линии (честоти) на тези серия може да се изчисли по следната формула:
Lyman серия намира в района на ултравиолетова и е образуван от електронни преходи от по-високите нива на енергия (Ni = 2, 3, 4 ...) на ниво нула (п = 1).
Балмер серия се намира в най-видими и ултравиолетови близо до регионите и Paschen серия - в инфрачервената област.
Структурата на енергийните нива на сложни атома сложно разделяне на електронните нива, в зависимост от взаимодействието между електроните и ядрото. Спектрите на такива атоми ивици.
1.2. Основни понятия на квантовата теория.
В съвременната квантова теория позиция на електрона в атом не е свързан с всеки орбита, т. Е. Не се установи точната позиция на електроните в обема на атома, и като се има предвид възможността за намиране на електрони в даден размер място. Цената на електрони се разпространява в целия атом, образувайки електронен облак променлива плътност. Плътността на електронен облак във всяка точка на обем атом съответства на вероятността за намиране на електрони в този момент.
В квантовата механика, състоянието на движение на електроните в един атом се характеризира с не един, а четири квантово число:
- В главно квантово число отнема само цели числа от 1 до безкрайност.
- Странични (или орбитален) квантово число л заема стойности от 0 до (N-1) (общо стойности N).
- магнитно квантово число мл е цяло число от -L до + L, включително 0 (общо (2л + 1) стойности).
- Spin квантово число MS могат да имат само две полу-целочислени стойности: + Уг и -½.
В квантовата числа определят възможните енергийните състояния на електроните в атома. Всеки електрон се характеризира с определен набор от квантово число. Събирането на електрони, характеризиращ се с главно квантово число на енергийното ниво на форми атом. Разпределението на електрони в атома на нивата на енергия се извършва въз основа на:
- Принципът на Паули. В атом може да бъде електрони, характеризиращ се с същия набор от квантово число.
- Принципът на минимална енергия. Разпределението на електрони в атома съответства на минималната енергия на атома.