Химично свързване на енергия (г) - количеството енергия, която се освобождава по време на образуването на
За многоатомни молекули с хомогенен свързващ енергия за връзки го приема средната стойност, изчислена чрез разделяне на енергията на образуването на съединението от атомите на броя на връзки. По този начин, тъй като енергията се абсорбира в Н 2О = 2Н + D е равно на 924 кДж / мол и молекула вода, и двете от О - H са химически еквивалент, средният свързващ енергия D (О-Н) = Ddiss. ./2 = 924/2 = 462 кДж / мол.
Важна характеристика на химичната връзка е неговата дължина л. равна на разстоянието между ядрата в връзката. Това зависи от размера на електронен слой, и тяхната степен на припокриване. За същия вид комуникация е определено съотношение между дължината и свързващата енергия: с намаляваща дължина връзка обикновено увеличава свързващата енергия и, съответно, молекулно стабилност. Например, за определен брой молекули в халогениди водородните
л (HF) увеличаване комуникация разстояние и енергийните намалява D (H-F)> D (HCl)> D (НВг)> D (HI). Основните видове химични връзки са йонни, ковалентна и метален. Йонната връзка е електростатично взаимодействие между отрицателно и положително заредени йони в химично съединение. Такова съобщение се появява, когато голяма разлика на Електроотрицателност от атоми, които участват в образуването на връзки. Подобна ситуация възниква с образуването на връзки между катионите S-елементи (метали) от първа и втора групи на периодичната система и аниони неметали групи VI и VII (LiF, CsCl, К2 О и др.). Голямата разлика в електроотрицателност (EO) атоми води до почти пълно прехвърляне на електрони от атомите на ЕО към ниски атоми с високо ее и тяхното йонизация. В резултат на доминиращата принос в свързващ енергия допринася Кулон взаимодействие между противоположно натоварени йони. Това е ковалентна химическа връзка, образувана от двойки електрони споделени от два атома. Когато разстоянието между два атома, например хлорни атоми, тяхното орбитали припокриване случи. В резултат на електронната плътност между ядрата на атомите се увеличава, и ядра са привлечени един към друг. При прекомерно конвергенция увеличава отблъскване на ядрата. Антагонизъм на тези две сили причинява потенциална енергия минимума на кривата на взаимодействие атомите, равна на свързващата енергия. Това съответства на оптимално минимално разстояние между ядрата, равна на дължината на LSV на свързване. Характеристиките на ковалентна химична връзка е вниманието си и насищане. Тъй като атомна орбитала са пространствено ориентирани, те се припокриват се среща в някои области, което води до ориентиране на ковалентната връзка. Количествено, ориентацията се изразява като връзката ъгли между посоките на химична връзка в молекули. Saturability ковалентна връзка се дължи на ограничаване на броя на електроните, участващи в неговото формиране. Един полезен параметър за описване на размера на атом участва в образуването на ковалентна връзка е радиус ковалентна rkov а. Тя се определя за един атом като X половината от дължината на типичен прост хомоядрени връзка Х-Х. Ако ковалентна връзка се формира от същите атоми, например N-Н, О = О и др. Това са равномерно разпределени споделени електрони между тях. Такава връзка се нарича неполярна ковалентна връзка. Ако един от атомите е по електроотрицателен от другия, електронната двойка се измества към по-електроотрицателна атом. В този случай, полярен ковалентна връзка. Колкото по-голяма разлика в electronegativities на атомите, образуващи връзка, толкова по-голяма полярност на връзката. В резултат на изместването на електрони от един атом на друг частичен отрицателен заряд е оформен на един от тях (повече електроотрицателна) (), от друга страна - частичен положителен заряд (). Това води до дипол - неутрален система с два еднакви големите положителни и отрицателни заряди, разположени една от друга на разстояние LD. нарича дължина дипол. Мярка за полярността на връзката е електрически диполен момент. равна на произведението на действителното съдържание на дължината на дипол Полярен ковалентна връзка с. близо до 1, може да се счита йонна връзка. Въпреки това, дори йонни съединения под единица. Следователно, всяко йонна връзка има определен дял на covalency. При описване на разпределението на електроните в молекули се използват два основни методи за изчисление: метода на валентните връзки на (Британска Колумбия) и метода на молекулно орбитален (MO). Методът на валентните връзки Sun се основава на следните основни принципи: а) химичната връзка между двата атома се появява в резултат на припокриване АО за да се образува електронни двойки (общи два електрона); б) атомите, които образуват връзка, се обменят между електроните, които образуват свързващи двойки. Обмяна на енергия на електроните между атомите (привличане енергийни атома) допринася за свързване на енергия. Допълнителна принос към свързващата енергия на силите на взаимодействие Кулон получаване на частиците; в) в химическата свързване участва електрони с противоположни завъртания; характеристики ж) химично свързване (енергия, дължина, полярност, и т.н.), се определя от вида на припокриване AO. Електронната структура на молекулата значително се различава от електронната структура на съставните атоми. Например, електрон орбитите на молекулата на водород не имат сферична симетрия разлика AO водороден атом, тъй като две център електронната двойка принадлежи молекулно система. В същото време, свързващ електронната двойка е по-ниско енергийно ниво от несдвоени електрони от водородни атоми. В резултат на образуването на молекули от атомите, подложени на промяна само електронната структура на външната обвивка и predvneshnih атоми. Следователно, в резултат молекула атоми с оригиналния електронен структура не съществува. В атома в молекулата се запазват само електронната конфигурацията на вътрешните електронен слой, не припокрива с образуването на връзки. Способността за свързване атом или замени определен брой други атоми, за да се образува химически връзки наречения валентен. Съгласно метода на Sun, всеки атом прави образуването на общата електронна двойка (ковалентна връзка), както е един несдвоен електрон. Количествена мярка на обмен валентността механизъм на въоръжените сили на метода е броят в земята или възбудено състояние на несдвоени електрони в атома. Те включват несдвоени електрони от външните обвивки на атома S- и р-елементи и външните обвивки predvneshnih d- елементи. При образуването химическо свързване атом може да се движи в възбудено състояние в резултат на разделяне на двойка или двойки електрони и прехода от една (или няколко електрони е равен на броя на отделя пара) орбитален на свободната черупката на същото. Така например, електронна конфигурация на калция в основното състояние 2 е записано като 4s. В съответствие с метод за обмен механизъм слънце валентността е нула, т.е. за Са (... 4s 2) valentnostV = 0. В калциев атом в четвъртата черупката (п = 4) са свободни р орбити. Когато развълнувани атоми и електрони настъпва димящи 4S- един свободен електрон се движи към 4S- орбитална. валентност на калций във възбудено състояние е равно на две, т.е. Готвенето на пара при валентност увеличава от две единици. Пространствената структура на молекулите. Както е показано по-горе, на ковалентна химическа връзка е посока, което се дължи за определяне на ориентацията на АД в пространството. Връзка, образувана чрез припокриване AO линия, свързваща ядрата комбиниращи атома се нарича # 963; -връзките. примери за образование # 963; -връзките са S-орбиталния припокриване, S- и р-орбитали, р-орбитите, D-орбитали, както и D- и S-орбитали, D- и р орбитали, и т.н. Някои от примерите # 963; -връзките, изброени по-долу.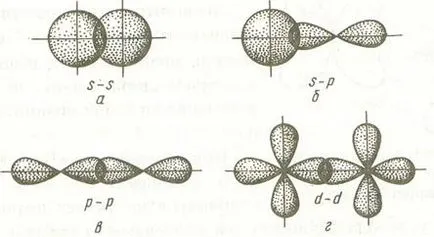
Можете да видите, че в случай на # 963; -връзките площ от максималната електронна плътност е на линия, свързваща ядрата на атомите.
Връзка, образувана чрез припокриване AO от двете страни на линията, свързваща ядрата на атомите (странично припокриване) се нарича π-връзка. π-връзка може да се образува чрез припокриване на р-р, р-D, F-Р, е-D и F-F-орбитите. По-долу са примери за формирането на пи-облигации.
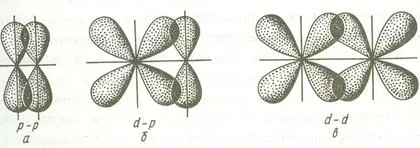
Тъй като образуването на я-връзки степен на припокриване на орбитали е малък в сравнение с # 963; -връзките, енергията на тези връзки е значително по-нисък.
При прилагане на π-на връзка # 963; -връзките образува двойна връзка, например, кислородни молекули, етилен, въглероден диоксид:
В налагане на двата я-облигациите на # 963; -връзките възниква тройна връзка, например, в молекулите на азот, ацетилен, циановодородна киселина:
Колкото по-висока комуникация множеството, толкова по своята енергия и по-ниска дължина на връзка.
Някои форми на съединенията не могат да бъдат обяснени по отношение на тяхното образуване на възбудени или спокоен глас атома. По този начин, всички връзки в молекулата метан С-Н са равни, което противоречи на набор от орбитали в възбудените и спокоен глас форми въглеродни атоми. Най-последователната подкрепа на този и други факти, открити в рамките на концепцията за хибридизация АД.
Хибридизация - смес от различни форма и енергийни орбитали атоми, в резултат на образуването на същия брой идентични енергия и форма хибридни орбити. Еквивалентността на хибридни орбитали отговорни не само за образуването на енергия еквивалент връзки, но също така подобна връзка ъгли между връзките, образувани от тези орбити. Трябва да се подчертае, че хибридният образува AO един атом с различна орбитали, където обект орбитална хибридизация имат подобни източници.
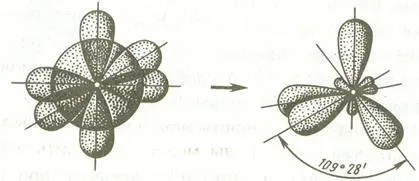
В случай на метан, хибридизация е резултат от смесване на три аудио S- и р-орбитите във възбудено състояние на въглеродните атоми, така наречените SP 3 хибридизация.
Образуването на хибридни орбитали благоприятно причинява енергия чрез тези орбитали химични съединения. Това се дължи на два фактора.
Първо, хибридни орбитите са асиметрични, което води до по-голяма степен на припокриване на образуването на химичните връзки и тяхната велика сила.
Второ, връзката ъгли между хибридни орбитите големи от не-сливане, което води до по-ниска степен на отблъскване между връзките на електрони, образувани от тези орбитали, и прави системата по-стабилна молекулна.
Когато SP 3 -hybridization на надлъжната ос на симетрия хибридни орбитали са разположени един спрямо друг под ъгъл 109º28 "- към съответните краища на тетраедър, в центъра на която е ядрото на атом.
Ако хибридизация е един обект S и две р орбитали, такъв тип се нарича хибридизация SP 2 - хибридизация, и ъглите между надлъжните оси на тези орбитали са равни и 120 съответства на минимално отблъскване между електроните валентните.
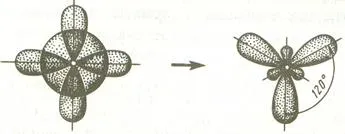
Когато смесен аудио s- и р-орбитали един държи SP-хибридизация. В този случай ъгълът между валентността орбитали хибриден 180 # 730; S.
Пространствената структура на молекулата се определя от броя на атомите в молекулата, хибридизация на орбитали и броя на несдвоени електрони върху тях, които отговарят за образуването на връзки.
Молекулата образуван от два атома е линейна. Ако външната обвивка на атома има две р несдвоен електрон, след това припокриването орбитали техните AO други атоми, молекули, образувани ъглово. Такива атоми включват атоми елементи р-VI група (О, S, Se, Te), електронна конфигурация на външните обвивки на които са представени по-долу.