Характеристики на пептидната връзка
Връзката на пептид в тяхната химична природа и е ковалентно свързан към високо съдържание на първичната структура на молекулата на протеин. Тъй като повтаряща се структурна единица на полипептидната верига, имащи специфичните характеристики на структурата, пептидната връзка влияе не само формата на първичната структура, но и на по-високи нива на организация на полипептидната верига.
Голям принос за изследването на структурата на молекулата на белтъка направи L.Poling и R.Kori. Чертеж внимание на факта, че молекулата на протеин е най-пептидни връзки, те бяха първите, проведено на старание изследвания рентгенова дифракция на връзката. Разглежда дължини и ъгли на свързване, чрез която атоми са подредени, посоката на подреждане на атомите на връзката. Въз основа на изследвания на следните основни характеристики са установени пептидна връзка.
1. Четири пептидна връзка атом (С, О, N, Н) и две прикрепен
а-въглероден атом лежат в една и съща равнина. Групи R и Н а-въглеродни атоми са извън тази равнина.
2. О и Н атоми на пептидната връзка и две а-въглеродни атоми, и R-групата са транс относителна ориентация на пептидната връзка.
3. Дължината на връзка C-N, е равна на 1.32 ÅИма междинна стойност между дължината на двойна ковалентна връзка (1.21 Å) И един-единствен ковалентна връзка (1.47 Å). От това следва, че C-N връзката е частично ненаситена характер. Това създава предпоставки за място тавтомерни двойни пренареждане връзката образуват енолна форма, т.е.. пептидна връзка може да съществува в кето-енолна форма.
Ротация около -C = N- връзка трудно и всички атоми, включени в пептидната група са конфигурация транс-равнинна. Цис-конфигурация е енергетично по-малко благоприятна и само в някои циклични пептиди. Всяка плоска пептиден фрагмент се състои от две връзки с а-въглеродни атоми, способни на въртене.
Между първичната структура на протеина и неговата функция в този организъм съществува най-близката връзка. За да се извърши характеристика му протеин функция изисква много специфична последователност на аминокиселини в полипептидната верига на протеина. Този конкретен аминокиселинна последователност, качествен и количествен състав на генетично определена (ДНК → РНК → протеин). Всеки протеин се характеризира с определена последователност от аминокиселини, замяната на най-малко една аминокиселина в протеин води не само до структурни промени, но също така и да промени в физико-химични свойства и биологични функции. Като първична структура предопределя последващите (вторични, третични, четвъртични) структури. Например, в еритроцити на здрави индивиди съдържа протеин-хемоглобин със специфична последователност на аминокиселина. Една малка част от хората имат вродена аномалия на хемоглобина структури: червените кръвни клетки съдържат хемоглобин, който в едно положение, вместо глутаминова киселина (зареден, полярен) съдържа валин амино киселина (хидрофобна, неполярен). Такова хемоглобина е значително различна физико-химични и биологични свойства на нормалното. Появата на хидрофобна амино киселина, води до появата на "лепкави" хидрофобен контакт (еритроцити лош ход в кръвоносните съдове), да променят формата на еритроцитите (на двойно вдлъбнати полумесец) и прехвърляне влошаване кислород и т.н. Децата, родени с тази аномалия, в ранна детска възраст умират от сърповидна анемия.
Обширна доказателства за твърдението, че биологичната активност се определя аминокиселинната последователност, са получени след изкуствено рибонуклеаза ензим синтез (Merrifield). Синтезираният полипептида, притежаващ същата амино киселинна последователност като естествения ензим има същата ензимна активност.
Изследванията през последните десетилетия са показали, че основната структура на фиксирана генетично, т.е. последователността на аминокиселини в полипептидната верига се определя от генетичния код на ДНК и на свой ред определя вторична, третична и четвъртична структура на молекулата на протеин и цялостната структура. Първият протеин, чиято основна структура е създадена, е протеинов хормон, инсулин (който съдържа 51 аминокиселини). Това беше направено през 1953 г. Frederikom Sengerom. Към днешна дата, първичната структура е решен за повече от десет хиляди протеини, но е много малко количество, ако се приеме, че естеството на протеини от около 10 12. В резултат на свободното въртене на полипептидни вериги способни на прегъвката (нагънат) в различни структури.
Вторичната структура. Съгласно вторичната структура на молекулата на протеин реализира метод на полагане на полипептидна верига в пространството. Вторичната структура на молекулата на протеин, образуван от една или друга форма на свободно въртене около връзките свързващи а-въглеродните атоми във веригата на полипептид .В резултат свободно въртене полипептидни вериги способни прегъвката (нагънат) в пространството в различни структури.
В природен полипептид вериги са три основни вида структура Намерено:
Най-вероятно тип структура на глобуларни протеини се счита # 945; спирала въртящ е по часовниковата стрелка (десен завой спирала), което е причинено от L-аминокиселинен състав на природни протеини. Движещата сила в появата на # 945; спирала е аминокиселина способността да образуват водородни връзки. R-амино група са насочени навън от централната ос а-спирала. диполи> С = О и> N-H съседен пептидни връзки са ориентирани оптимално дипол взаимодействие, при което се образува широка система на съвместни междумолекулни водородни връзки, които стабилизират а-спирала.
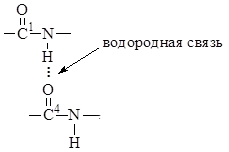
Спираловидната терена (един пълен оборот) 5.4Å 3.6 включва амино киселинен остатък.
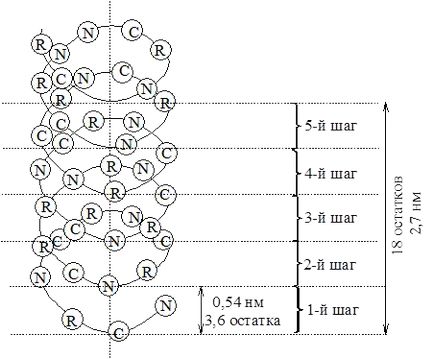
Фигура 2 - структурата и параметри на а-спирала протеин
За всеки протеин се характеризира с определена степен на спираловидно си полипептидна верига
Може да наруши спираловидна структура от два фактора:
1) в присъствието на пролинови остатъци във веригата, циклична структура, която се въвежда чупка в полипептидната верига - не -NH2 групи. така че е невъзможно вътреверижни образуване на водородна връзка;
2) Ако полипептидната верига много остатъци последователни амино киселини, притежаващи положителен заряд (лизин, аргинин) или отрицателно зареден (глутаминова, аспартамова киселина), в този случай силна взаимна отблъскване odnoimennozaryazhennyh групи (-СОО - или -NN3 +) значително надвишава стабилизирането ефекта на водородните връзки в а-спирала.
Друг тип конфигурация на намерени в протеини на коса, коприна, мускулите и други влакнести протеини вериги полипептидните, наречен # 946; строежи, или сгънат лист. тип структура на сгънатия лист и се стабилизира чрез водородни връзки между същите -NH диполи. О = С<. Однако в этом случае возникает совершенно иная структура, при которой остов полипептидной цепи вытянут таким образом, что имеет зигзагообразную структуру. Складчатые участки полипептидной цепи проявляют кооперативные свойства, т.е. стремятся расположиться рядом в белковой молекуле, и формируют параллельные
odinakovonapravlennye или антипаралелни полипептидни вериги,
се засилва чрез водородни връзки между веригите. Такива структури са наречени б-нагънат листове (Фигура 2).
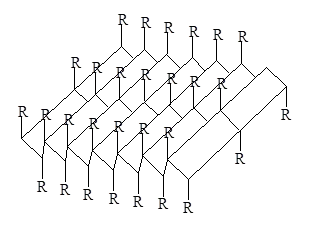
Фигура 3 - б-структура на полипептидните вериги
а-спирала и нагънати листове - са подредени структура, в която има редовен подреждане на аминокиселинните остатъци в пространството. Някои части от полипептидната верига то няма никакъв редовен периодичен пространствена организация. те са по-хаотични или на кълбо.
Третичната структура. Tretichnoystrukturoy по начин да се разбере полипептидната верига опаковане в пространството на определен обем.
Третичната структура на протеини е образувана от допълнително нагъване на пептидната верига, съдържаща а-спирала, б-структура и случаен винтови части. Третичен протеинова структура се образува напълно автоматично, спонтанно и напълно предварително определена първична структура и има пряко отношение към формата на протеиновата молекула, която може да бъде различен от сферичната на нишковидните. Формата на протеинова молекула се характеризира с такива параметри като степента на асиметрия (съотношение на дългата ос на кратко). В ресничести или фибриларни белтъци степен на асиметрия е по-голямо от 80. Ако степента на асиметрия е по-малко от 80 принадлежат към кълбовидни протеини. Повечето от тях са степента на асиметрия на 3-5, т.е. Третична структура се характеризира с плътно опаковане на полипептидната верига, приближава формата на балона.
При образуването на глобуларни протеини, хидрофобните радикали неполярни аминокиселини са групирани в протеиновата молекула, докато полярни радикали са ориентирани към водата. В един момент, не е термодинамично най-благоприятна структура на молекулата е стабилна - глобули. В тази форма, протеиновата молекула се характеризира с най-ниска свободна енергия. На възникнал глобули конформация се влияе от такива фактори като рН, йонната сила на разтвора, и взаимодействието на молекулата на протеина с други вещества.
Основната движеща сила в случай на триизмерна структура, е взаимодействието на радикали на амино киселина с водни молекули.
Фибриларни протеини. В образуването на третични структури не образуват глобули - техните полипептидни вериги не се отстраняват, но остават разширени под формата на линейни вериги групирани в volokna- фибрили.
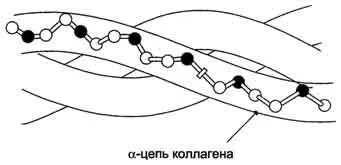
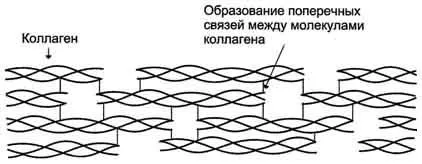
Figure- структура на колагенови фибрили (фрагмент).
Напоследък има доказателства, че образуването на третичната структура не е автоматично, но се регулира и контролира от специални молекулни механизми. Процесът включва специфични протеини - чаперони. Основните характеристики са тяхната способност да се предотврати образуването на полипептидна верига неспецифични (хаотични) неподредени възли и гарантиране доставката (транспорт), за да си субклетъчни цели, създаване на условия за завършване на коагулация на протеиновата молекула.
Стабилизиране третичната структура се осигурява чрез нековалентни взаимодействия между страничните вериги атомни групи.
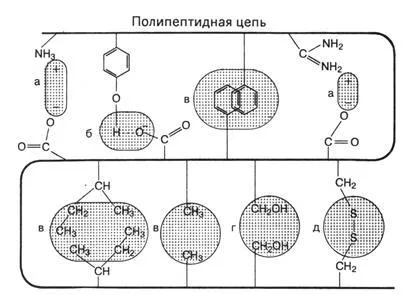
Фигура 4 Видове връзки, които стабилизират третичната структура на протеина
а) електростатичните сили на привличане между радикали, съдържащи противоположно заредени йонни групи (йон-йонни взаимодействия), като отрицателно зареден карбоксилна група (- СОО -) аспарагинова киселина и (NH3 +), положително заредени е-амино група на лизин.
б) водородни връзки между функционалните групи на страничните вериги. Например, между ОН група на тирозин и аспарагинова киселина карбоксил кислород
в) хидрофобно взаимодействие поради ван дер Ваалс сили между неполярни амино радикали. (например, групи
-СН3 - аланин, валин, и др ..
г) взаимодействие дипол-дипол
г) дисулфидни връзки (-S-S-) между цистеини. Тази връзка е много силна и не присъства във всички протеини. Важна роля в тази връзка се играе от протеиновите вещества на зърно и брашно, като Това се отразява на качеството на глутена, структурни и механични свойства на тестото и по този начин качеството на крайните продукти - хляб и т.н.
Протеин глобули не е напълно твърда структура: в коридори известни, обратими пептидна верига движещи се части една спрямо друга с разлика от малко количество слаби връзки и образуването на нови. Молекула, тъй като диша, пулсира в ритъма в различните му части. Тези вълни не нарушават основния план на структурата на молекулата, подобно на флуктуация на атомите в кристала не променя кристалната структура, ако температурата не е толкова голяма, че се случва на топене.
Едва след придобиване на протеиновата молекула, естествен, роден третична структура, той проявява своята специфична функционална активност: катализатор, хормон, антиген и т.н. Това е образуването на третична структура е образуване на активни центрове на ензими центрове, отговорни за вграждане на мултиен комплекс протеин, центрове отговорен за nadmolekulyanyh структури самосглобяване. Следователно, всяко въздействие (термично, физични, механични, химични), което води до разрушаване на нативния протеин конформация на (облигации разграждат) е придружен от частична или пълна загуба на биологичните свойства на протеина.
Проучване пълни химическите структури на някои протеини показват, че тяхната третична структура идентифицирани област, където концентрирани радикали хидрофобни аминокиселини и полипептидна верига действително увити около хидрофобно ядро. Освен това, в някои случаи в протеиновата молекула отделят две или дори три от хидрофобно ядро, което води до две или три-ядрена структура. Този вид на молекулната структура типично за много протеини, имащи каталитична функция (рибонуклеаза, лизозим и т.н.). Отделна част или регион на протеинова молекула има определена степен на структурно и функционално автономия се нарича домейн. Редица ензими, например, изолиране на субстрат-свързващи и свързващи коензим домени.
Биологично фибриларни белтъци играят много важна роля, свързана с анатомията и физиологията на животните. В гръбначни, делът на тези протеини съставляват 1/3 от общото съдържание. Примери fibrilyarnyh копринени протеини могат да служат като протеин - фиброин, който се състои от множество паралелни вериги със структурата на сгънатия лист. А-кератин протеин съдържа между 3-7 вериги. Колагенът има сложна структура, в която веригите 3 са същите лево-усукани заедно за образуване на тройна спирала дясновъртящ. Тази тройна спирала се стабилизира чрез множество междумолекулни водородни връзки. Наличието на аминокиселини като хидроксипролин и хидроксилизин също допринася за образуването на водородни връзки, които стабилизират структурата на тройна спирала. Всички фибриларни протеини са слабо разтворими или напълно неразтворими във вода, като в техния състав съдържа много аминокиселини, съдържащи хидрофобен, неразтворими във вода R-група изолевцин, фенилаланин, валин, аланин, метионин. След специално третиране неразтворим и несмилаем колаген превръща желатин разтворима смес от полипептиди, които след това се използват в хранително-вкусовата промишленост.
Кълбовидните протеини. Извършване на различни биологични функции. Те изпълняват функцията на транспорта, т.е. носят хранителни вещества, неорганични йони, липиди и т.н. Този клас протеини принадлежат към хормони, както и компоненти на мембрани и рибозоми. Всички ензими са също глобуларни протеини.
В кватернерна структура. Протеини, съдържащи две или повече полипептидни вериги, наречени олигомерни протеини. те се характеризират с присъствието на четвъртичната структура.
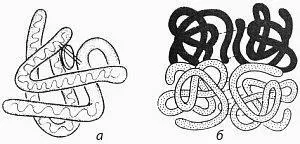
Тираж - третични Схеми (а) и (б) кватернерни протеинови структури
В олигомерен протеин от полипептидни вериги, всяка характеризираща се с първична, вторична и третична структура, и се нарича протомери или субединица полипептидна верига (протомери) в такива протеини могат да бъдат или еднакви или различни. Олигомерните протеини, наречени хомогенни, ако те са идентични протомери хетерогенна и ако те са различни протомери. Например протеина хемоглобин, състояща се от 4 вериги: две -а и -B две протомери. А-амилаза ензим се състои от 2 идентични полипептидни вериги. Съгласно кватернерна структура разбере подреждане на полипептидни вериги (протомерите) един спрямо друг, т.е. начин за съвместната им подреждане и опаковане. Така протомери реагират един с друг не на всяка част от повърхността си, и известна част (контактната повърхност). Контактните повърхности имат разположението на атомни групи, между които са водород, йонни, хидрофобни връзки. Освен това, протомери геометрия също така улеснява тяхната връзка. Протомери си пасват като ключ. Такива повърхности са наречени комплементарни. Всяка протомер взаимодейства с друг в множество точки, това води до факта, че връзката с други полипептидни вериги или протеини невъзможно. Такива комплементарни взаимодействие на молекули са в основата на всички биохимични процеси в организма.